
【题目】现有下列物质 ①NaHCO3 ②液态SO2 ③纯醋酸 ④硫酸钡 ⑤液氨 ⑥酒精 ⑦NH3·H2O ⑧铝 ⑨NaHSO4
请用以上物质回答下列问题。(填序号)
(1)属于强电解质的是_____________,属于弱电解质的是_____________。
(2)属于非电解质,但其水溶液能导电的是_____________。
(3)写出⑨在熔融条件下的电离方程式:______________________________________。
(4)写出⑦在水溶液中的电离方程式:______________________________________。
(5)写出①和⑨的水溶液反应的离子方程式:_______________________________________。
【答案】①④⑨ ③⑦ ②⑤ NaHSO4= Na++HSO4- NH3·H2O![]() NH4++OH- HCO3-+H+=CO2↑+H2O
NH4++OH- HCO3-+H+=CO2↑+H2O
【解析】
①NaHCO3属于强碱弱酸盐,属于强电解质;
②液态SO2在水中以及在熔融状态下均不能发生电离,属于非电解质,其溶于水后生成H2SO3,H2SO3在水中能够发生电离,其溶液能够导电;
③纯醋酸在水中能够发生不完全电离,属于弱电解质;
④硫酸钡在熔融状态下能够发生完全电离,属于强电解质;
⑤液氨在水中以及在熔融状态下均不能发生电离,属于非电解质,其溶于水后生成NH3·H2O,NH3·H2O在水中能够发生电离,其溶液能够导电;
⑥酒精在水中以及在熔融状态下均不能发生电离,属于非电解质,其在水中不能发生反应,不会发生电离,其溶液不导电;
⑦NH3·H2O在水中能够发生不完全电离,属于弱电解质;
⑧铝为单质,不属于电解质,也不属于非电解质;
⑨NaHSO4属于强酸酸式盐,在水中或熔融状态下均能够发生完全电离,属于强电解质;
(1)属于强电解质的是:①④⑨;属于弱电解质的是:③⑦,
故答案为:①④⑨;③⑦;
(2)属于非电解质,但其水溶液能导电的是:②⑤,
故答案为:②⑤;
(3)NaHSO4为强电解质,其在熔融状态下的电离方程式为:NaHSO4= Na++HSO4-,
故答案为:NaHSO4= Na++HSO4-;
(4)NH3·H2O为弱电解质,其在水溶液中的电离方程式为:NH3·H2O![]() NH4++OH-,
NH4++OH-,
故答案为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
(5)NaHCO3与NaHSO4对于水溶液的离子反应方程式为:HCO3-+H+=CO2↑+H2O,
故答案为:HCO3-+H+=CO2↑+H2O。


科目:高中化学 来源: 题型:
【题目】乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置 (夹持装置已略)如图所示:下列说法错误的是( )
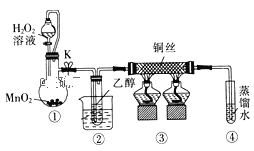
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应 N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H = -92.0 kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJB. 一定等于92.0 kJ
C. 一定小于92.0 kJD. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知![]() ,下列有关叙述错误的是( )
,下列有关叙述错误的是( )

A.HA、HB两种酸中,HB的酸性弱于HA
B.b点时,![]()
C.同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D.向HB溶液中加入NaOH溶液所得的混合溶液中,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)![]() 3Z(g)并达平衡。下列说法正确的是
3Z(g)并达平衡。下列说法正确的是
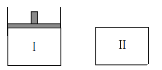
A.从起始到平衡所需时间:Ⅰ>Ⅱ
B.平衡时Z的转化率:Ⅰ<Ⅱ
C.平衡后若在Ⅰ中再加入0.1molY,则X的物质的量将减少
D.平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol·L-1·min-1,且此时A、B的物质的量浓度之比为2∶3。下列说法错误的是
A.x的值是2
B.开始时B的物质的量为3mol
C.5min时,B的物质的量浓度为1.5 mol·L-1
D.5min时,容器中气体总的物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) N2(g)+CO2(g)。向容积均为l L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
0min | 40min | 80min | 120min | 160min | ||
甲 | T℃ | 2mol | 1.45 mol | 1 mol | 1 mol | 1 mol |
乙 | 400℃ | 2 mol | 1.5 mol | 1.1 mol | 0.8 mol | 0.8 mol |
丙 | 400℃ | 1 mol | 0.8 mol | 0.65 mol | 0.53 mol | 0.45 mol |
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____________________;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,l mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
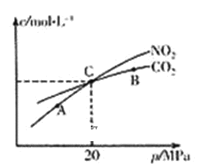
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=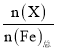 ]。下列说法正确的是( )
]。下列说法正确的是( )

A.K2FeO4、H2FeO4都属于强电解质
B.25℃,H2FeO4+H+![]() H3FeO4+的平衡常数K>100
H3FeO4+的平衡常数K>100
C.由B点数据可知,H2FeO4的第一步电离常数Ka1=4.15×10-4
D.A、C两点对应溶液中水的电离程度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com