
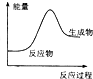
| A. | 氧化钙溶于水 | B. | 碳酸钙高温煅烧分解 | ||
| C. | 酸和碱的中和反应 | D. | 铝粉与氧铁粉末反应 |
科目:高中化学 来源: 题型:选择题
| A. | 将甲、乙作电极组成原电池时,甲是负极 | |
| B. | 同价态的阳离子,甲比乙的氧化性强 | |
| C. | 甲与稀盐酸反应放出氢气的体积比乙与稀盐酸反应放出氢气的体积大 | |
| D. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沼气是一种清洁的能源 | |
| B. | 使用沼气做能源是解决农村能源的主要途径 | |
| C. | 使用沼气给农民的生活带来了不便 | |
| D. | 使用沼气是对化学能的充分利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O;
+2H2O;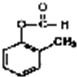 发生银镜反应的化学方程式:
发生银镜反应的化学方程式: +2Ag(NH3)2OH$\stackrel{水浴加热}{→}$
+2Ag(NH3)2OH$\stackrel{水浴加热}{→}$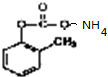 +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O; 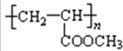 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体 | |
| B. | 聚乙烯、聚氯乙烯,纤维素都属于合成高分子 | |
| C. | 分馏、干馏,裂化都是化学变化 | |
| D. | 石蜡油分解产物可使溴水和酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是化学变化 | B. | 没有能量变化 | ||
| C. | 有C-C、C-H键的断裂 | D. | 有C-C、C-H键的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )| 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
| B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 |
| C | 检验FeSO4受热分解产生的气体中有SO3和SO2 | BaCl2溶液 | 品红溶液 |
| D | 验证醋酸、碳酸、硅酸酸性强弱 | NaOH溶液 | Na2SiO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com