
【题目】对于实验IIV的实验现象预测正确的是( ) 
A.实验Ⅰ:逐滴滴加盐酸时,试管中立即产生大量气泡
B.实验Ⅱ:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验Ⅲ:从饱和食盐水中提取NaCl晶体
D.装置Ⅳ:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去
【答案】D
【解析】解:A.先发生碳酸钠与盐酸的反应生成碳酸氢钠,则开始没有气泡,故A错误;
B.四氯化碳的密度比水的大,充分振荡后静置,下层溶液为橙红色,上层为氯化铁溶液,为黄色,故B错误;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作,不需要坩埚,应选蒸发皿,故C错误;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色,观察到性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去,故D正确;
故选:D.
A.先发生碳酸钠与盐酸的反应生成碳酸氢钠;
B.上层为氯化铁溶液,为黄色;
C.从饱和食盐水中提取NaCl晶体,利用蒸发操作;
D.浓硫酸具有脱水性,蔗糖变为C,然后与浓硫酸反应生成二氧化硫,具有还原性,使酸性KMnO4溶液褪色.


科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 淀粉![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 纤维素![]() 葡萄糖
葡萄糖![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
D. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法中正确的是
A. 乙苯的同分异构体有三种
B. 丙烯与溴的四氯化碳溶液反应能生成BrCH2CH2CH2Br
C. 己二酸(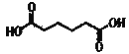 )可以发生氧化反应、取代反应、加聚反应
)可以发生氧化反应、取代反应、加聚反应
D. 有机物 分子中所有碳原子不可能共平面
分子中所有碳原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的离子组是
A.Na+、OH一、HCO3- B.NH4+、NO3—、OH—
C.H+、K+、CO32-、 D.Ba2+、OH一、C1—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。实验室用氯化钠、废铁屑、稀硫酸、氢氧化钾溶液等为原料,通过以下过程制备高铁酸钾(K2FeO4):

(l) Na2O2的电子式为__________。
(2)操作I的步骤为蒸发浓缩、冷却结晶、过滤、洗涤、隔绝空气减压干燥.其中隔绝空气减压干燥的目的是_______。
(3)气体X为____,写出FeSO4与Na2O2反应的化学方程式:________。
(4)最终在溶液中可得到K2FeO4 晶体的原理是_________。
(5)已知K2FeO4在水溶液中可以发生:4FeO42-+10H2O![]() 4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
4Fe(OH)3(胶体)+8OH-+3O2↑,,则K2FeO4 可以在水处理中的作用是__________。
(6)称取提纯后的K2FeO4样品0.2100g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250mL 溶液,取出25.00 mL放入锥形瓶,用0.0l000mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00mL。涉及的主要反应为:Cr(OH)4-+FeO42-=Fe(OH)3+CrO42-+OH-
Cr2O72-+6Fe2++14H+=6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO![]() 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com