
| A、氢硫酸溶液加水稀释,电离程度增大,H+浓度增大 |
| B、同体积同pH的盐酸和醋酸与足量的锌反应,醋酸的反应速率快,生成H2的物质的量多 |
| C、NaHCO3溶液不显中性的原因:HCO3-+H2O≒CO32-+H3O+ |
| D、Na2CO3溶液中满足:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
 某同学设计了一种电解法制取Fe(OH)2的实验装置,如图所示通电后,B极表面有气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色,下列说法正确的是.
某同学设计了一种电解法制取Fe(OH)2的实验装置,如图所示通电后,B极表面有气泡产生,且溶液中产生大量的白色沉淀,较长时间不变色,下列说法正确的是.| A、电源a是负极 |
| B、电解质溶液一定是NaOH溶液 |
| C、A、B两端都必须用铁做电极 |
| D、B极附近溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠块浮于液面上,四处游动 |
| B、金属钠熔化成液态小球 |
| C、烧杯内溶液颜色逐渐变红 |
| D、听到(可燃性气体)轻微的爆鸣声 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热煮沸MgCO3悬浊液,最终得到Mg(OH)2沉淀,说明Ksp(MgCO3)<Ksp[Mg(OH)2] |
| B、因为NH3的水溶液可以导电,所以NH3是电解质 |
| C、向污水中投入明矾,生成能凝悬浮物的胶体 |
| D、90℃水的离子积Kw=3.8×10-13,此时水的pH<7,溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加NaOH |
| B、加盐酸 |
| C、加NH4Cl |
| D、加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
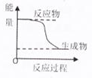
| A、化学平衡发生移动,平衡常数不一定发生变化 |
| B、升高温度会增大化学反应速率,其原因是增加了活化分子的百分数 |
| C、某化学反应的能量变化如图所示,则反应的△H>0 |
| D、电解熔融Al2O3是将部分电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、焓变是与反应能否自发进行有关的因素,多数能自发进行的反应都是放热反应 |
| B、一个反应能否自发进行取决于该反应放热还是吸热 |
| C、在同一条件下不同物质有不同的熵值,其体系的混乱程度越大,熵值越大 |
| D、一个反应能否自发进行,与焓变和熵变的共同影响有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com