
【题目】设NA为阿伏加德罗常数的数值,下列有关叙述正确的是
A.1mol乙醇经催化氧化生成乙醛后转移的电子数为4NA
B.30g由14C2H2和C18O组成的混合气体中含有的质子数为14NA
C.标准状况下,44.8LSO2与足量O2反应生成的SO3分子数为2NA
D.标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA
【答案】B
【解析】
A.1mol乙醇经催化氧化生成乙醛,乙醇的碳由-2价转变成乙醛中的碳-1价,1mol乙醇转移2mol电子,转移的电子数为2NA,故A错误;
B. 14C2H2和C18O的相对分子质量均为30,且1分子中含有的质子数均为14个,则30g由14C2H2和C18O组成的混合气体即1mol气体中含有的质子数为14mol,即14NA,故B正确;
C.该反应为可逆反应,44.8LSO2即2mol不能完全反应,生成的SO3分子数小于2NA,故C错误;
D.氯气与氢氧化钠发生反应:![]() ,1mol氯气中转移1mol电子,则2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA,故D错误;
,1mol氯气中转移1mol电子,则2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.1NA,故D错误;
故选:B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】(1)①CaCO3(s)=CaO(s) + CO2(g) ΔH = + 177.7 kJ·mol-1
②C(s) + H2O(g)=CO(g) + H2(g) ΔH = -131.3 kJ·mol-1
③1/2H2SO4(l) + NaOH(l)=1/2Na2SO4(l) + H2O(l) ΔH = -57.3 kJ·mol-1
④C(s) + O2(g)=CO2(g) ΔH = -393.5 kJ·mol-1
⑤CO(g) + 1/2O2(g)=CO2(g) ΔH = -283 kJ·mol-1
(a)上述热化学方程式中表示不正确的有__(填序号)。
(b)根据上述信息,写出C转化为CO的热化学方程式__________。
(2)已知热化学方程式:H2(g)+1/2O2(g)=H2O(g)ΔH = -241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为__kJ·mol-1。
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+ 4NO2(g)=4NO(g)+ CO2(g)+ 2H2O(g) ΔH =﹣574 kJ·mol-1
CH4(g)+ 4NO(g)=2N2(g)+ CO2(g)+ 2H2O(g) ΔH =﹣1160 kJ·mol-1
若用标准状况下4.48 L CH4还原NO2生成N2,反应中转移的电子总数为__(用阿伏加德罗常数NA表示),放出的热量为__kJ。
(4)下列有关中和热的说法正确的是(________)
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH= -57.3 kJ·mol-1
B.准确测量中和热的实验过程中,至少需记录温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1,则该反应的中和热为57.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予锂离子电池领域。LiFePO4(磷酸亚铁锂) 是锂离子电池的一种电极材料,可通过下列方法制备:
方法一:2FePO4(s)+Li2 CO3(s)+2C(s)2LiFePO4(s)+3CO(g)
(1)该反应的平衡常数表达式为_____。若在容积不变的容器中,上述反应达到平衡时,一氧化碳的浓度为amolL﹣1,再充入bmol一氧化碳,则平衡向_____方向移动,达到新平衡时,一氧化碳的浓度为_____。
(2)一定温度下,在2L密闭容器中发生上述反应。反应进行到20min时,容器内固体的质量减少了5.6g,则0~20min内一氧化碳的平均反应速率是_____。
方法二:LiFePO4可以通过(NH4)2Fe(SO4)2、H3PO4与Li OH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而制得。
(3)氢氧化钠碱性比氢氧化锂碱性强,请用元素周期律知识说明理由_____。
(4)共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合,其原因是_____。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,放电时,负极为_____(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为_____。
LiFePO4,放电时,负极为_____(填写化学式)。若用该电池电解饱和食盐水(电解池电极均为惰性电极),当电解池两极共有4480mL气体(标准状况)产生时,该电池消耗锂的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验①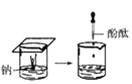 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②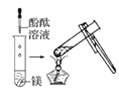 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③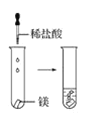 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④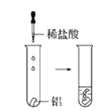 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的有( )
①氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;
②测定新制氯水的pH时,先用玻璃棒蘸取液体滴在pH试纸上,再与标准比色卡对照
③用米汤直接检验食用盐中是否含有碘元素;
④pH在5.6~7.0之间的降水通常称为酸雨;
⑤加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO![]() 存在
存在
⑥SO2通入紫色石蕊试液,溶液先变红后褪色
⑦配制一定物质的量浓度的氢氧化钠溶液,用烧杯称量后加蒸馏水溶解,未冷却到室温便转移到容量瓶中,导致结果偏高
⑧分解高锰酸钾制氧气后,残留在试管内壁上的黑色物质可用稀盐酸洗涤;
⑨蒸干AlCl3溶液可得纯净的无水氯化铝;
⑩2H2(g)+O2(g)=2H2O(g) △H1和2H2(g)+O2(g) =2H2O(l) △H2中的△H1>△H2。
A.5个B.6个C.7个D.8个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.25℃时某溶液中水电离出的c(H+)=1.0×1012 mol·L1,其pH一定是12
B.某温度下,向氨水中通入CO2,随着CO2的通入,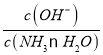 不断增大
不断增大
C.恒温恒容下,反应X(g)+3Y(g) ![]() 2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
2Z(g),起始充入3 mol X和3 mol Y,当X的体积分数不变时,反应达到平衡
D.某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,该温度下加入等体积pH=10的NaOH溶液可使反应后的溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是

A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com