
【题目】根据下图所示实验,回答问题:
(1)实验①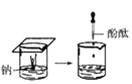 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②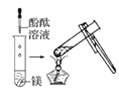 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③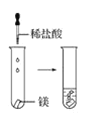 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④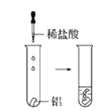 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
【答案】熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色 镁条溶解有无色气泡冒出 铝条缓慢溶解有无色气泡冒出 钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易 钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al 同周期元素(如钠、镁、铝),随着原子序数的递增,原子的核电荷数增多,原子半径减小,原子核对最外层电子的吸引力增强,失去最外层电子逐渐变难,元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐减弱
【解析】
结合Na、Mg、Al的金属活泼性差异并参照金属性强弱的判断依据和元素周期律分析解答即可。
(1)实验①钠放入水中,反应后滴加酚酞试液可观察到的现象是熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红;实验②是水中加入镁粉并滴加酚酞,然后放在酒精灯上加热,实验过程中观察到的现象是加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色;
(2)实验③是向盛有镁块的试管中滴加稀盐酸,观察到的现象是镁条溶解有无色气泡冒出;实验④是向盛有铝块的试管中滴加稀盐酸,观察到的现象是铝条缓慢溶解有无色气泡冒出;
(3)由实验①②③④观察到的实验现象,可知钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易;
(4)Na、Mg、Al均为第三周期的主族元素,且核电荷数依次增大,由实验①②③④可得钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al,存在活泼性差异的原因是同周期元素(如钠、镁、铝),随着原子序数的递增,原子的核电荷数增多,原子半径减小,原子核对最外层电子的吸引力增强,失去最外层电子逐渐变难,元素的金属性逐渐减弱,最高价氧化物对应水化物的碱性逐渐减弱。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行请根据上面流程,回答以下问题:
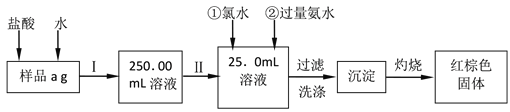
(1)操作I是配制溶液,所用到的玻璃仪器除烧杯、玻璃棒外,还必须有、_________。(填仪器名称)
(2)下列操作可能使所配溶液浓度偏小的是__________(填写序号)。
①未洗涤烧杯和玻璃棒
②定容时俯视容量瓶的刻度线
③配溶液前容量瓶中有少量蒸馏水
④摇匀后,发现液面低于刻度线后继续加水至凹液面与刻度线相切
(3)请写出加入过量氨水时发生的离子反应方程式____________,
(4)检验沉淀是否已经洗涤干净的操作是__________。
(5)若原样品质量a为10g,加热后红棕色固体质量是6g,则样品中铁元素的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=+23.5kJmol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
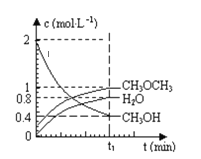
(1)该条件下反应平衡常数表达式K=___。在t1℃时,反应的平衡常数为___。用CH3OH表示的化学反应速率___。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4molL-1、c(H2O)=0.6molL-1、c(CH3OCH3)=1.2molL-1,此时正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核都是由质子和中子构成的
B.一个氕原子核实际上就是一个质子
C.某原子的相对原子质量就是该原子的质量与一个碳—12原子质量的比值
D.质量数是个化学概念,某元素的质量与该元素的近似相对原子质量在数值上相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组研究金属钾的性质。他们首先通过分析钾与钠的原子结构示意图及查阅有关资料,知道钾与钠属于同一类物质,在性质上有许多相似之处。但在金属活动性顺序表中,钾排在钠的前面,钾在空气中燃烧的产物是超氧化钾(KO2)。
(1)预测钾的化学性质,完成下列反应的化学方程式:
①钾在氯气中燃烧____________________________;
②点燃钾剧烈燃烧_____________________________;
③将小块钾投入冷水中______________________________;
(2)推测钾在自然界中的存在方式是(填“游离态”或“化合态”)________。
(3)该小组研究钾的性质时用到的主要方法有____________________________________。
(4)他们研究金属钾性质的程序是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得2个电子、B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数。C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个。
(1)A的元素名称是_______,B的元素符号是______。
(2)D原子的原子结构示意图为____________,B+的离子结构示意图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是探究温度对化学反应速率的影响的实验,其中三支试管中均为3 mL滴有FeCl3溶液的5% H2O2溶液(如下图所示)。
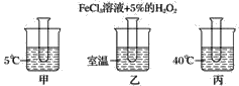
(1)三支试管内溶液产生氧气气泡速率由大到小为________。
(2)由上述实验可得出的结论为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g)
pC(g)
(I)若达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为___热反应,且m+n__p(填“>”、“=”或“<”)。
(2)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色___;而维持容器内压强不变,充入氖气时,混合物颜色___。(填“变深”、“变浅”或“不变”)。
(II)若在容积可变的密闭容器中发生反应,在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如表
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/mol·L-1 | 0.08 | 0.20 | 0.44 |
(1)当压强从2×105Pa增加到5×105Pa时,平衡___移动(填:向左,向右,不)。
(2)维持压强为2×105Pa,当反应达到平衡状态时,体系中共有amol气体,再向体系中加入b molB,当重新达到平衡时,体系中气体总物质的量是___mol。
(3)当压强为1×106Pa时,此反应的平衡常数表达式:___。
(4)其他条件相同时,在上述三个压强下分别发生该反应。2×105Pa时,A的转化率随时间变化如图,请在图中补充画出压强分别为5×105Pa和1×106Pa时,A的转化率随时间的变化曲线(请在图线上标出压强)。____
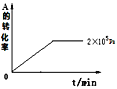
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com