
【题目】已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=+23.5kJmol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
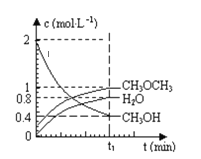
(1)该条件下反应平衡常数表达式K=___。在t1℃时,反应的平衡常数为___。用CH3OH表示的化学反应速率___。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4molL-1、c(H2O)=0.6molL-1、c(CH3OCH3)=1.2molL-1,此时正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业合成的常用氧化剂和催化剂,如图所示的微生物电池,能利用K2Cr2O7实现对含苯酚(或醛类)废水的有效处理,该电池工作一段时间后,中间室内的NaC1溶液浓度减小,则下列叙述正确的是

A.a电极为负极,电子从a电极经过中间室到达b电极
B.M为阳离子交换膜,电解过程中中间室内的n(NaC1)减小
C.处理含苯甲醛废水时a电极反应式为:C6H5CHO-32e-+13H2O=7CO2+32H+
D.当b电极消耗等物质的量的K2Cr2O7时,a电极消耗的C6H5OH或C6H5CHO的物质的量之比为8:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容积为1L的密闭容器中通入1mol CO2和3mol H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
CH3OH(g)+H2O(g) ΔH<0。下列有关说法正确的是
A. 该反应在高温下才能自发进行
B. 再加入一定量CO2,则n(CH3OH)/n(CO2)减小
C. 温度升高,反应的平衡常数K增大
D. 当CO2和H2转化率相等时,该反应达到化学平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一块镁铝合金投入到1mol/L盐酸中,待合金完全溶解后(盐酸有剩余),再往溶液里加入1mol/LNaOH溶液,生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。下列说法中错误的是( )
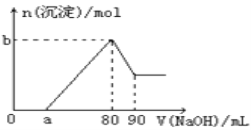
A. 盐酸的体积为80mL
B. a的取值范围为0<a<50
C. 当a值为30时,b值为0.01
D. n(Mg2+)<0.025mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜、铁、铝等在人类文明史上先后被广泛使用。回答下列问题:
(1)铜、银、金三种金属在元素周期表同族且依次相邻,因此价电子层结构相似。银原子价层电子排布式为________;金元素在周期表的位置是________。
(2)观察如下循环图可以获知FeO的晶格能为________ kJ·mol-1。

(3)氯化铝熔点194℃,会升华,熔融态不易导电。实验测得气态氯化铝分子组成式为Al2Cl6,其结构式为________;气态氯化铝中存在________(填选项标号)
A.离子键 B.配位键 C.氢键 D.范德华力 E.金属键 F.非极性共价键
(4)石墨微观结构如下图。其中碳原子杂化类型为________。金刚石晶体中碳碳键键长为0.155nm。金刚石的熔点略低于石墨,而远高于C60的原因是________。
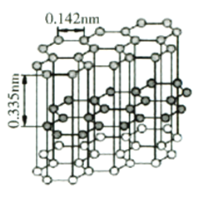
(5)设阿伏加德罗常数值为NA,则石墨的密度为________![]() (列出计算表达式)
(列出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示实验,回答问题:
(1)实验① 观察到的现象是________________________。实验②
观察到的现象是________________________。实验②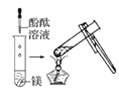 观察到的现象是________________________。
观察到的现象是________________________。
(2)实验③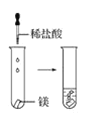 观察到的现象是________________________。实验④
观察到的现象是________________________。实验④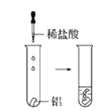 观察到的现象是________________________。
观察到的现象是________________________。
(3)由上述实验,你能得出的结论是________________________。
(4)请总结同周期元素金属性的变化规律__________,并用原子结构解释其原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L恒容密闭容器中3种物质间进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t1 min 时达到平衡。
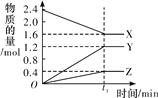
(1)请写出该反应的化学方程式:_____________________________。
(2)若上述反应中X、Y、Z分别为NH3、H2、N2,且已知1 mol 氨气分解成氮气和氢气要吸收46 kJ的热量,则至t1 min时,该反应吸收的热量为________;在此t1 min时间内,用H2表示该反应的平均速率v(H2)为__________。下列叙述能判断该反应达到平衡状态的是________(填字母代号)。
A.容器内各气体组分的质量分数不再发生改变
B.正反应速率与逆反应速率相等
C.容器内气体的密度不再发生改变
D.混合气体的平均相对分子质量不再发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com