
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgCl2固体。
A.①②③⑤B.③⑥C.③D.③⑤
科目:高中化学 来源: 题型:
【题目】下列实验与图象对应的是
选项 | A | B | C | D |
实验 | NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
图象 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二甲醚是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:2CH3OH(g)CH3OCH3(g)+H2O(g)△H=+23.5kJmol-1。在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。请回答下列问题:
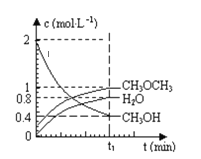
(1)该条件下反应平衡常数表达式K=___。在t1℃时,反应的平衡常数为___。用CH3OH表示的化学反应速率___。
(2)相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4molL-1、c(H2O)=0.6molL-1、c(CH3OCH3)=1.2molL-1,此时正、逆反应速率的大小:v(正)_____v(逆)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某简单(单核)粒子的原子核外有10个电子。
(1)若为原子,请画出其原子结构示意图______________。
(2)若为阳离子,请写出其常见的离子符号______________。
(3)若为阴离子,请写出其常见的离子符号______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气,将多余的氯气用100 mL 1.7mol/L的NaOH溶液完全吸收。对吸收后的溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化) 。ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
(1)吸收氯气消耗的NaOH的物质的量为_______________mol。
(2)被氧化的氯气的物质的量为_______________mol,被还原的氯气的物质的量为 _______________mol。
(3)若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.原子核都是由质子和中子构成的
B.一个氕原子核实际上就是一个质子
C.某原子的相对原子质量就是该原子的质量与一个碳—12原子质量的比值
D.质量数是个化学概念,某元素的质量与该元素的近似相对原子质量在数值上相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素的原子得2个电子、B元素的原子失去1个电子后所形成的微粒均与氩原子有相同的核外电子数。C元素的原子只有1个电子,A、D两元素原子核外电子总数比B元素原子质子数多9个。
(1)A的元素名称是_______,B的元素符号是______。
(2)D原子的原子结构示意图为____________,B+的离子结构示意图__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
反应时间/min | 0 | t1 | t2 |
n(CO)/mol | 1.20 | 0.80 | |
n(H2O)/mol | 0.60 | 0.20 | |
n(CO2)/mol | 0 | ||
n(H2)mol | 0 |
下列说法正确的是
A.反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com