
分析 (1)若镁铝合金过量时,与50ml盐酸反应生成气体的体积为6.72L(标况下测得),依据生成氢气的物质的量计算盐酸溶液的浓度;
(2)若6.3g镁铝合金与足量盐酸反应生成气体的物质的量为0.3mol,依据质量总和和气体总物质的量列式计算计算得到混合物中镁和铝的物质的量之比.
解答 解:(1)若镁铝合金过量时,与50ml盐酸反应生成气体的体积为6.72L(标况下测得),气体物质的量n=$\frac{6.72L}{22.4L/mol}$=0.3mol,2H+~H2,氢离子物质的量=0.6mol,计算50ml盐酸所含的HCl的物质的量为12mol,
答:50ml盐酸所含的HCl的物质的量为12mol;
(2)若6.3g镁铝合金与足量盐酸反应生成气体的物质的量为0.3mol,设镁铝物质的量为x、y,
Mg~H2,
1 1
x x
2Al~3H2,
2 3
y 1.5y
24x+27y=6.3
x+1.5y=0.3,
x=0.15mol
y=0.1mol,
混合物中镁和铝的物质的量之比=0.15:0.1=3:2,
答:混合物中镁和铝的物质的量之比为3:2.
点评 本题考查了化学方程式的计算,注意定量关系的分析应用,掌握基础是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应物总能量为679kj | |
| B. | 生成物总能量为431kj | |
| C. | 氢气和氯气反应生成2mol氯化氢气体,反应放出183kJ能量 | |
| D. | 氢气和氯气反应生成2mol氯化氢气体,反应吸收183kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 578 | 1817 | 2745 | 11575 | 14830 | 18376 | 23293 |
| A. | ⅠA | B. | ⅡA | C. | ⅢA | D. | ⅣA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
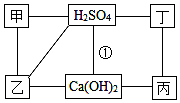 如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.
如图中的每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol 氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键 | |
| B. | 同温同压下,H2(g)+Cl2=2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键 | |
| D. | 反应A(g)?2B(g),若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则该反应的△H=(Ea-Eb) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知:HI(g)?$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(s)△H=-26.5 kJ•mol-1,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量 | |
| B. | 已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则氢气的燃烧热△H=-571.6 kJ•mol-1 | |
| C. | 肼(N2H4)是一种用于火箭或燃料电池的原料,已知2H2O(g)+O2(g)═2H2O2(l)△H1=+108.3 kJ•mol-1 ① N2H4(l)+O2(g)═N2(g)+2H2O(g)△H2=-534.0 kJ•mol-1 ② 则有反应:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l)△H=-642.3 kJ•mol-1 | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
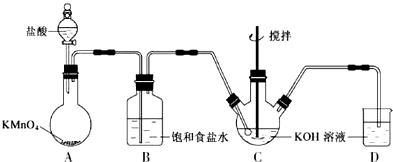
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com