
| A�� | ��Ӧ��������Ϊ679kj | |
| B�� | ������������Ϊ431kj | |
| C�� | ������������Ӧ����2mol�Ȼ������壬��Ӧ�ų�183kJ���� | |
| D�� | ������������Ӧ����2mol�Ȼ������壬��Ӧ����183kJ���� |
���� A����Ӧ��ϼ����յ����������ڷ�Ӧ�����������
B����Ӧ��ɼ��ų����������������������������
C��������������Ӧ�����Ȼ�������ķ�ӦΪ���ȷ�Ӧ��
D��������������Ӧ�����Ȼ�������ķ�ӦΪ���ȷ�Ӧ��
��� �⣺A����Ӧ��ϼ����յ����������ڷ�Ӧ�������������Ӧ���ܼ���Ϊ679kJ����A����
B����Ӧ��ɼ��ų�����������������������������������ܼ���Ϊ431kJ����B����
C��H2��g��+Cl2��g��=2HCl��g���ķ�Ӧ��=��Ӧ����ܼ���-��������ܼ���=436kJ•mol-1+243kJ•mol-1-2��431 kJ•mol-1=-183kJ•mol-1����1mol������1mol������Ӧ����2mol�Ȼ�������ʱ�ų�����Ϊ183KJ����C��ȷ��
D��H2��g��+Cl2��g��=2HCl��g���ķ�Ӧ��=��Ӧ����ܼ���-��������ܼ���=436kJ•mol-1+243kJ•mol-1-2��431 kJ•mol-1=-183kJ•mol-1����1mol������1mol������Ӧ����2mol�Ȼ�������ʱ�ų�����Ϊ183KJ����D����
��ѡC��
���� ������Ҫ�����˷�Ӧ�ȵļ��㣬�ѶȲ���ע�������Ȼ�ѧ����ʽ����д����ȷ��Ӧ�ȵ��ڷ�Ӧ����ܼ���-��������ܼ��ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
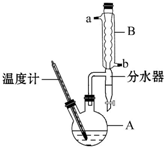 1-����鳣�����л���Ӧ���ܼ���ʵ�����Ʊ�1-����飨CH3CH2CH2Br���ķ�Ӧ����Ҫʵ��װ����ͼ��
1-����鳣�����л���Ӧ���ܼ���ʵ�����Ʊ�1-����飨CH3CH2CH2Br���ķ�Ӧ����Ҫʵ��װ����ͼ��| ��Է� ������ | �ܶ� /g•mL-1 | �е�/�� | ˮ�� �ܽ��� | |
| ������ | 60 | 0.896 | 97.1 | �� |
| ������ | 102 | 0.74 | 90 | �������� |
| 1-����� | 123 | 1.36 | 71 | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
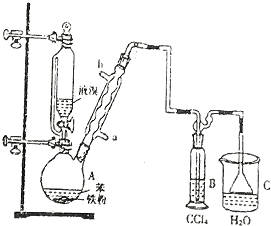
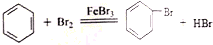 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
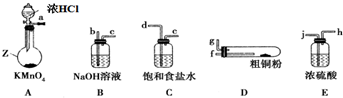

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
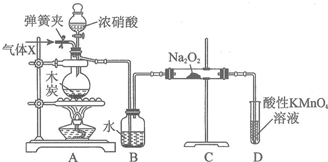
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
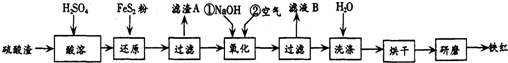
| ������ | Fe��OH��3 | Al��OH��3 | Fe��OH��2 | Mg��OH��2 |
| ��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
| ��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧǰ�������ѹǿ֮��Ϊ2��1 | |
| B�� | ��Ӧǰ��������ܶ�֮��Ϊ15��16 | |
| C�� | ��ʱCO��ת����Ϊ50% | |
| D�� | �����Ӧ������������У������ƽ����Է�����������С |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com