
| A、1010:1 |
| B、5×109:1 |
| C、108:1 |
| D、1:1 |
| 1×10-14 |
| 10-11 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、石油的裂化和裂解可以得到烯烃 |
| B、石油的催化重整是获得芳香烃的主要途径 |
| C、石油分馏出的各馏分均是纯净物 |
| D、煤干馏产生的煤焦油经分馏可得到芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、Cl-、CO32- |
| B、Na+、Ca2+、CO32-、NO3- |
| C、Na+、Ca2+、Cl-、NO3- |
| D、K+、H+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
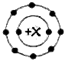 表示核外电子排布的常见阳离子共有( )
表示核外电子排布的常见阳离子共有( )| A、1种 | B、2种 | C、3种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、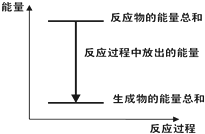 反应过程中能量关系可用如图表示 |
| B、△H的值与反应方程式的计量系数有关 |
| C、若将该反应设计成原电池锌为负极 |
| D、若将其设计为原电池当有32.5g锌溶解时,正极放出气体一定为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三种元素的单质都存在同素异形体 |
| B、二氧化物都属于酸性氧化物,能与碱反应而不能与任何酸反应 |
| C、最低价的气态氢化物都具有较强的还原性,能与O2发生反应 |
| D、含氧酸的钠盐水溶液有呈碱性的,有呈中性、也有酸性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)△H>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )
已知某可逆反应在密闭容器中进行:A(g)+2B(g)?3C(g)△H>0,如图中曲线a代表一定条件下该反应的过程,若使a曲线变为b曲线,可采取的措施是( )| A、恒温恒容条件下将A、B的浓度增加一倍 |
| B、恒温条件下加压(缩小容器体积) |
| C、使用合适的催化剂 |
| D、升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com