
硫酸镍铵[(NH4) xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:
①准确称取2.335 0 g样品,配制成100.00 mL溶液A;
②准确量取25.00 mL溶液A,用0.040 00 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-===NiY2-+2H+),消耗EDTA标准溶液31.25 mL;
③另取25.00 mL溶液A,加足量NaOH溶液并充分加热,生成NH3 56.00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA标准溶液润洗,测得的Ni2+含量将________(填“偏高”“偏低”或“不变”)。
(2)氨气常用 检验,现象是
(3)通过计算确定硫酸镍铵的化学式(写出计算过程)。
.8分 (1)偏高(1分)
(2)湿润的红色石蕊试纸 (1分) 试纸颜色由红变蓝(1分)
(3) n(Ni2+)=0.040 00 mol·L-1×31.25 mL×10-3 L·mL-1=1.250×10-3 mol
n(NH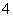 )=
)= =2.500×10-3 mol
=2.500×10-3 mol
n(SO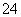 )=
)= =
=
=2.500×10-3 mol
m(Ni2+)=59 g·mol-1×1.250×10-3 mol=0.073 75 g
m(NH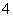 )=18 g·mol-1×2.500×10-3 mol=0.045 00 g
)=18 g·mol-1×2.500×10-3 mol=0.045 00 g
m(SO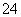 )=96 g·mol-1×2.500×10-3 mol=0.240 0 g
)=96 g·mol-1×2.500×10-3 mol=0.240 0 g
n(H2O)=
=1.250×10-2 mol
x∶y∶m∶n=n(NH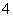 )∶n(Ni2+)∶n(SO
)∶n(Ni2+)∶n(SO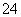 )∶n(H2O)=2∶1∶2∶10
)∶n(H2O)=2∶1∶2∶10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O (5分)


科目:高中化学 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
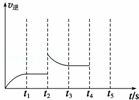
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
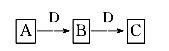 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。请按要求回答下列问题:
(1)若B、C为氧化物且C对应的水化物为强酸。B转化为C时,质量增加25%,则氢化物A转化为B的化学方程式是_____ __ __。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则B生成C的化学方程式是____ ____,将B的溶液加热蒸干再灼烧,得到的固体物质的化学式是__________。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是__________________________________________;符合条件的D物质可能是________(填序号)。
①硫酸 ②醋酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案中,不能达到实验目的的是
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.6.4g B.4.8g C.2.4g D.1.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水 B.向地势低的地方撤离
C.观察风向,顺风撤离 D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是 ( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32- = CO2↑+ H2O
B.氢氧化钡溶液与盐酸反应:OH-+H+ = H2O
C.硫酸铜溶液与氢氧化钡溶液混合:Cu2+ + 2 OH-= Cu(OH)2↓
D.钠投入水中:Na +H2O = Na+ + OH- + H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,有关金属腐蚀的下列说法不正确的是
A. 钢铁制品腐蚀时正极反应:O2+2H2O+4e-=4OH-
B. 在酸性较强的溶液中,金属主要发生析氢腐蚀
C. 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接
D. 在海轮外壳上附着一些锌块,则可以减缓海轮外壳的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:A(g)+2B(g)⇌ C(g)+D(g)已达到平衡状态( )
①混合气体的压强;②混合气体的密度;③各气体物质的物质量浓度;④气体的总物质的量;⑤混合气体的平均相对分子质量.
|
| A. | ②③⑤ | B. | ①②③ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com