
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
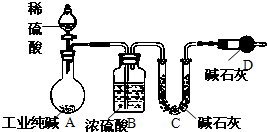 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如图实验装置.依据实验设计,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
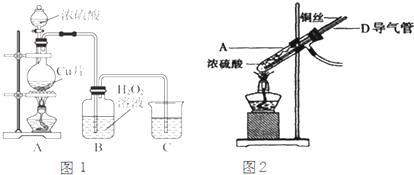
 根据正放在桌面上的如图装置,回答下列问题:
根据正放在桌面上的如图装置,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸,产生使澄清石灰水变浑浊的无色气体 | 该溶液中一定含CO32- |
| B | 某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中含有SO42- |
| C | SO2可使酸性KMnO4溶液褪色 | SO2具有漂白性 |
| D | 某溶液中加入NaOH溶液,加热,产生能使湿润的红色石蕊试纸变蓝色的气体 | 该溶液中含有NH4+离子 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
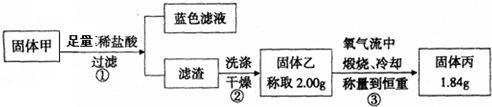
查看答案和解析>>
科目:高中化学 来源: 题型:
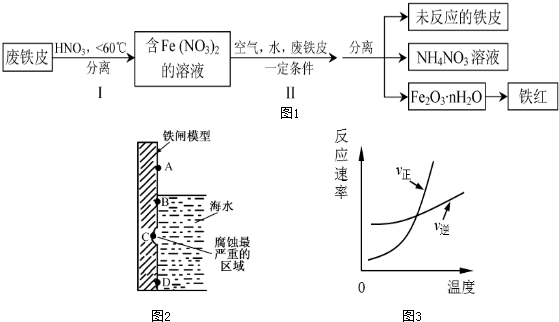
查看答案和解析>>
科目:高中化学 来源: 题型:
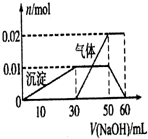 某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种
某无色透明溶液只可能含有Ba2+、NH4+、K+、Al3+、Fe 3+、Cl-、SO42-离子中的几种查看答案和解析>>
科目:高中化学 来源: 题型:
A、已知 ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y ,反应物X与产物Y互为同分异构体,可用溴水或FeBr3溶液鉴别X和Y |
B、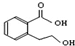 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 |
| C、3-甲基-3-乙基戊烷的一氯取代产物为5种 |
| D、相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com