
| c(CO2) |
| c(CO) |
| ||
| ||
| c(CO2) |
| c(CO) |
| ||
| 5min |
| c(CO2) |
| c(CO) |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
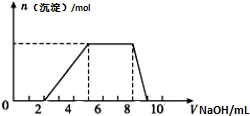 某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )
某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-.当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示,下列说法正确的是( )| A、原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+ |
| B、反应最后形成的溶液中的溶质含AlCl3 |
| C、原溶液中Al3+与NH4+的物质的量之比1:3 |
| D、原溶液中含有的阴离子是AlO2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )
有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则原混合溶液中Cl-与SO42-的物质的量之比为( )| A、1:1 | B、2:1 |
| C、3:2 | D、2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.4g |
| B、3.36g |
| C、5.60g |
| D、10.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是制取、干燥和收集某气体的实验装置,可用于( )
如图是制取、干燥和收集某气体的实验装置,可用于( )| A、用Zn与稀H2SO4反应制H2 |
| B、用CaO与浓氨水反应制NH3 |
| C、用Cu与稀HNO3反应制NO |
| D、用MnO2与浓HCl反应制C12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.
X、Y、Z、W四种物质之间有如右图所示的转化关系(部分物质未写全),且已知反应热之间的关系符合等式:△H=△H1+△H2,符合上述要求的X、Y可能是①S、SO2 ②AlCl3、Al(OH)3 ③CH2=CH2、CH3CH3 ④CH3OH、HCHO.| A、①② | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将浓度为0.1 mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、25℃时,等体积、等pH的HCl、H2SO4、CH3COOH溶液分别与足量锌粉反应,H2SO4溶液产生的H2量最多 |
| C、Na2CO3溶液存在水解平衡:CO32-+H2O?HCO3-+OH-,加入NaOH固体会使平衡逆向移动,溶液pH减小 |
| D、25℃时,pH均为8的CH3COONa和NaOH溶液中,由水电解产生的c(OH-)之比为100:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com