
【题目】“立方烷”是新合成的一种烃,其分子为正立方体结构。
(1)“立方烷”的分子式是_____。
(2) “立方烷”分子中可能有的结构是_____。(从A、B、C、D中选)。
A.![]()
B.![]()
C.
D.![]()
(3) “立方烷”可能发生的反应或变化有_____。(从A、B、C、D中选)。
A.可使Br2水褪色,但不反应
B.不能使溴的CCl4溶液褪色
C.能发生取代反应
D.能发生加成反应
(4) “立方烷”的一种同分异构体为芳香烃,此芳香烃能发生加聚反应,其结构简式为_____,发生的加聚反应化学方程式为_____。
【答案】C8H8 C ABC ![]()
![]()
【解析】
(1)立方体有8个顶点,则该立方烷分子中含有8个碳,且每个碳原子形成3个C-C键,所以每个碳原子还会与1个氢原子相连接。
(2)既然是“烷”,就不可能存在双键等不饱和键,由此可确定分子内不可能含有的结构片断。
(3)立方烷虽然不属于烷烃,但它具有烷烃的某些性质。
(4) “立方烷”的一种同分异构体为芳香烃,则分子内含有苯环,去掉C6H5-,还剩余-C2H3,此基团为-CH=CH2,于是可得出该有机物的结构简式及性质。
(1)由前面分析可知,“立方烷”分子中含有8个碳原子,每个碳原子上连有1个氢原子,从而得出分子式是C8H8。答案为:C8H8;
(2)既然是“烷”,就不可能存在双键、苯环等结构,只能含单键,则“立方烷”分子中可能有的结构是C。答案为:C;
(3) “立方烷”可能发生的反应或变化有_____。(从A、B、C、D中选)。
A.可使Br2水褪色,但不反应,即发生萃取作用,如汽油就具有此性质,A符合题意;
B.立方烷分子中不含有碳碳不饱和键,不能使溴的CCl4溶液褪色,B符合题意;
C.立方烷具有C-H键,能发生取代反应,C符合题意;
D.立方烷分子中不含有碳碳不饱和键,不能发生加成反应,D不合题意;答案为:ABC;
(4) ““立方烷”的一种同分异构体为芳香烃,则分子内含有苯环,去掉C6H5-,还剩余-C2H3,此基团为-CH=CH2,于是可得出该有机物的结构简式为![]() ,发生的加聚反应化学方程式为
,发生的加聚反应化学方程式为![]() 。答案为:
。答案为:![]() ;
;![]() 。
。


科目:高中化学 来源: 题型:
【题目】钠和铜的单质及其化合物在社会实际中有着广泛的应用。
(1)NaCl晶体的晶胞结构如图所示,每个NaCl的晶胞中含有的阴离子的个数为__,阳离子周围最近且等距离得阴离子的个数为__。
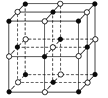
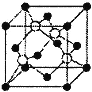
(2)碘化钠溶液和硫酸铜溶液能反应生成一种铜的碘化物A(白色沉淀),A的晶胞如右图所示,则A的化学式是__,A中铜元素的化合价为__。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水到沉淀刚好全部溶解可得到深蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀,该物质中的NH3通过___键与中心离子Cu2+结合,NH3分子中N原子的杂化方式是__。与NH3分子互为等电子体的一种阳离子是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示的装置,模拟工业用含硫废水生产Na2S2O3·5H2O的过程。

锥形瓶C中发生反应:
①Na2S+H2O+SO2→Na2SO3+S
②2H2S+SO2→3S↓+2H2O
③S+Na2SO3![]() Na2S2O3
Na2S2O3
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若__________________,则整个装置气密性良好。装置D的作用是_________。装置E中为_________溶液。
(2)装置B可用于观察SO2的生成速率,其中的液体最好选择_________。
a.饱和食盐水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
锥形瓶C的溶液中含有Na2S和过量的Na2SO3.已知反应③的速率是三个反应中最慢的,则锥形瓶C中反应达到终点的现象是__________。
(3)反应结束后,锥形瓶C的溶液中除含Na2S2O3,还可能含Na2SO3、Na2SO4等杂质。用所给试剂设计实验,检测锥形瓶C的溶液中是否存在Na2SO4(供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液)简要说明实验操作,现象和结论:_________________。
(4)实验前锥形瓶C溶液中含有0.08molNa2S和0.04molNa2SO3,反应结束后经一系列操作,得到纯净的Na2S2O3·5H2O晶体19.11g,则Na2S2O3·5H2O产率是_________(Na2S2O3·5H2O式量248)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素M、N、P、Q最高价氧化物对应水化物分别为X、Y、Z、W,M是短周期中原子半径最大的元素,常温下X、Z、W均可与Y反应,M、P、Q的原子序数及0.1mol/LX、Z、W溶液的pH如图所示。下列说法正确的是( )
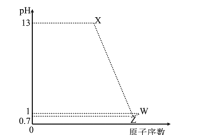
A.N原子的电子层数与最外层电子数相等
B.M的离子半径小于N的离子半径
C.P氢化物稳定性大于Q氢化物稳定性
D.X、W两物质含有的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O35H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15gNa2S2O3加入圆底烧瓶中,再加入80mL蒸馏水。另取5g研细的硫粉,用3mL乙醇润湿,加入上述溶液中。
②安装实验装置,水浴加热,微沸60分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O35H2O,经过滤,洗涤,干燥,得到产品。
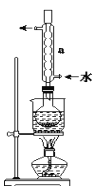
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是___。
(2)仪器a的名称是___,其作用是___。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是___,检验是否存在该杂质的方法是___。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因为___。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定,反应原理为:2S2O32-+I2=S4O62-+2I-。
(5)滴定至终点时,溶液颜色的变化为___。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为___ mL。产品的纯度为___(设Na2S2O35H2O相对分子质量为M)。
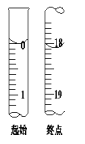
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)位于元素周期表中第ⅤA族,其价态为+3时较稳定,铋酸钠(NaBiO3)溶液呈无色。现取一定量的硫酸锰(MnSO4)溶液,向其中依次滴加下列溶液,对应的现象如表所示:

在上述实验条件下,下列结论正确的是
A.BiO3-的氧化性强于MnO4-
B.H2O2被高锰酸根离子还原成O2
C.H2O2具有氧化性,能把KI氧化成I2
D.在KI-淀粉溶液中滴加铋酸钠溶液,溶液一定变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3DZn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3DZn—NiOOH二次电池,结构如下图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是
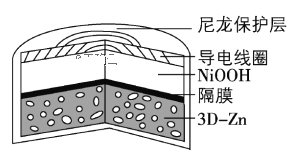
A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电过程中OH通过隔膜从负极区移向正极区
C.充电时阴极反应为ZnO(s)+H2O(l) +2e= Zn(s)+2OH(aq)
D.放电时正极反应为NiOOH(s)+H2O(l) +e =Ni(OH)2(s)+OH(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为____________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向80mL 0.1molL-1稀HNO3溶液中加入铜粉和铁粉混合物,固体完全溶解,在反应后溶液中滴加硫氰化钾溶液,溶液没有出现血红色。铜粉和铁粉混合物的质量可能是
A.0.168gB.0.184gC.0.192gD.0.200g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com