
某化学活动小组设计如下图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
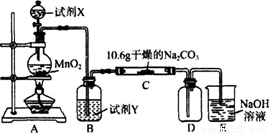
(1)写出装置A中发生反应的离子方程式:
(2)写出试剂Y的名称:_____________________。
(3)已知:通入一定量的氯气后,测得D中只有一种常温下为黄红色的气体,其为含氯氧化物。可以确定的是C中含有的氯盐只有一种,且含有NaHCO3,现对C成分进行猜想和探究。
①提出合理假设:
假设一:存在两种成分: NaHCO3和__________
假设二:存在三种成分: NaHCO3和__________、___________。
②设计方案,进行实验。请写出实验步骤以及预期现象和结论(可不填满)。
限选实验试剂和仪器:蒸馏水、稀硝酸、BaCl2溶液、澄清石灰水、AgNO3溶液、试管、小烧杯。
|
实验步骤 |
预期现象和结论 |
|
步骤1:取C中的少量固体样品于试管中,滴加 足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中。 |
|
|
步骤2:向A试管中滴加______________: |
①若无明显现象,证明固体中不含碳酸钠; ②若溶液变浑浊,证明固体中含有碳酸钠。 |
|
步骤3:向B试管中滴加______________: |
若溶液变浑浊,结合步骤2中的①,则假设 一成立:结合步骤2中的②,则假设二成立。 |
(4)己知C中有0.1 mol Cl2参加反应。若假设一成立,可推知C中反应的化学方程式为 。
(5)常温下Na2CO3和NaHCO3均为0.1mol/L的混合溶液中,c(OH﹣)-c(H+)=___________(用含碳元素的粒子浓度表示),在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有______________________。
(1)4H+ +2Cl- +MnO2=Mn2+ +Cl2↑+2H2O(2分)
(2)饱和食盐水(2分)
(3)NaCl; NaCl、Na2CO3 (各1分);BaCl2溶液(2分);AgNO3溶液(2分)
(4)2Cl2+ 2Na2CO3 + H2O =2 NaHCO3 + 2NaCl+ Cl2O(2分)
(5)1/2 c (HCO3-)+3/2 c (H2CO3)-1/2 c(CO32-)(2分);NaCl、NaHCO3 、CO2(或H2CO3)(2分)
【解析】
试题分析: (1)本题探究的是氯气和碳酸钠反应,所以A装置为氯气的制备装置,所以发生的离子方程式为:4H+ +2Cl- +MnO2=Mn2+ +Cl2↑+2H2O。
(2)浓盐酸易挥发,所以氯气中混有HCl气体,B装置为除杂装置,试剂选用饱和食盐水溶液。
(3)①根据题意,反应所得的C中只有一种氯盐,还含有NaHCO3,所以该氯盐是NaCl,所以假设一为NaHCO3和NaCl,假设二的三种成分分别为NaHCO3 、NaCl、Na2CO3 。
②设计方案验证假设,则应该证明NaCl、Na2CO3 的存在,即证明Cl-、CO32- 的存在。根据实验步骤,步骤2为碳酸根的检验,因此可选用试剂BaCl2溶液,若有白色沉淀产生,说明有碳酸钠,无明显现象则没有碳酸钠;步骤3为检验氯离子,因此选用试剂AgNO3溶液,若白色沉淀产生变浑浊则存在氯化钠,若无明显现象,则无氯化钠,再结合步骤2讨论假设成立。
(4) 若假设一成立,则生成物为氯化钠和碳酸氢钠,所以必然有H2O参加反应,同时生成了黄红色的气体,所以该气体为氯的氧化物Cl2O,发生了氧化还原反应,方程式为:2Cl2+ 2Na2CO3 + H2O =2 NaHCO3 + 2NaCl+ Cl2O。
(5)根据电荷守恒,相同条件下浓度均为0.1mol/LNa2CO3和NaHCO3的混合溶液有电荷守恒式:c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),若不考虑弱离子水解,则c(Na+)=0.3mol/L,c(CO32-)=c(HCO3-)=0.1mol/L,所以c(Na+)=3/2[c(CO32-)前+c(HCO3-)前];由于CO32-、HCO3-均发生水解产生了H2CO3 ,所以水解以后c(Na+)=3/2[c(CO32-)前+c(HCO3-)前]=3/2[c(CO32-)+c(HCO3-) +C(H2CO3)];把此式带入到电荷守恒式得3/2[c(CO32-)+c(HCO3-) +C(H2CO3)] +c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),移项得c(OH﹣)-c(H+)=3/2[c(CO32-)+c(HCO3-) +C(H2CO3)]- 2c(CO32-)-c(HCO3-)=1/2 c (HCO3-)+3/2 c (H2CO3)-1/2 c(CO32-)。在该溶液中滴加稀盐酸至中性时,溶液中溶质的成分有NaCl、NaHCO3 、CO2 。
考点:本题考查的是实验探究、氧化还原反应方程式的配平、离子检验、离子浓度大小比较等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤l:取c中的少量固体样品于试管中,滴加足量蒸馏 水至同体溶解,然后将所得溶液分别置于a、b试管中. |
无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加适量BaCl2溶液 向A试管中滴加适量BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中. | 无明显现象 无明显现象 |
| 步骤2: 向A试管中滴加BaCl2溶液 向A试管中滴加BaCl2溶液 |
a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量C中固体样品于试管中,加入足量蒸馏水,充分振荡至固体完全溶解,然后将所得溶液分装A、B两支试管中. | |
| 步骤2: | |
| 步骤3: | |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. |
 |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a. a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3: 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 |
b. 若溶液变浑浊,证明固体中含有NaCl 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
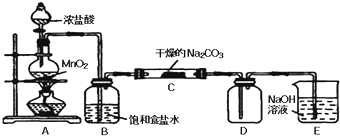
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置 | 若溶液变浑浊,证明固体中含碳酸钠. |
| 步骤3: |
|
| 步骤4: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com