
室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25 ℃其溶度积为2.8×10-9,下列说法不正确的是
A.加入蒸馏水可使溶液由d点变到a点
B.c点时有碳酸钙沉淀生成
C.x数值为2×10-5
D.b点与d点对应的溶度积相等
科目:高中化学 来源: 题型:
下列事实的解释正确的是( )
A. 将SO2 、SO3 混合气体通入氯化钡溶液中,出现浑浊是因为生成了BaSO4沉淀
B. SO2通入溴水中,溴水褪色,是因为SO2的漂白性
C. 反应2C + SiO2  Si +2CO ,是因为碳的非金属性强于硅的非金属性
Si +2CO ,是因为碳的非金属性强于硅的非金属性
D. 在NaHCO3的溶液中滴加NaAlO2溶液中有白色沉淀生成,是因为二者发生完全水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
核内质子数不同,核外电子数相同的两种微粒,它们可以是( )
A.同种元素的两种离子 B.同种元素的原子和离子
C.不同种元素的离子 D.不同种元素的原子和离子
查看答案和解析>>
科目:高中化学 来源: 题型:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用右图所示的装置制取乙酸乙酯。回答下列问题:
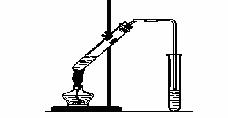
(1)写出制取乙酸乙酯的化学反应方程式 。
(2)浓硫酸的作用是:① ;② 。
(3)饱和碳酸钠溶液的主要作用是 。
(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见表,表中的“实验步骤”与“实验现象”前后不一定是对应的关系)。
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”的响声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究________元素性质递变规律。
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlCl3溶液,NaOH溶液,酚酞溶液等。
仪器:①________,②________,③________,试管夹,胶头滴管,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式)
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) |
①__________________,②____________________。
(4)实验结论:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种药物主要成分X的分子结构如右下图所示:
关于有机物X的说法中,不正确的是
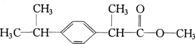
A.X 难溶于水,易溶于有机溶剂
B.X 能跟溴水发生加成反应
C.X 能使酸性高锰酸钾溶液褪色
D.X 的水解产物能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol氦气中有2NA个氦原子
B.14 g氮气中含NA个氮原子
C.2 L 0.3 mol·L-1 Na2SO4溶液中含0.6 NA个Na+
D.18 g水中所含的电子数为8NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com