
【题目】有机化合物H的结构简式为![]() ,其合成路线如下(部分反应略去试剂和条件):
,其合成路线如下(部分反应略去试剂和条件):
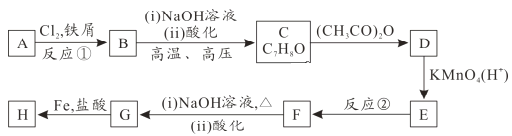
已知:①![]()
②![]() (苯胺易被氧化)
(苯胺易被氧化)
请回答下列问题:
(1)烃A的名称为_______,B中官能团为_______,H的分子式为_______,反应②的反应类型是_______。
(2)上述流程中设计C→D的目的是_______。
(3)写出D与足量NaOH溶液反应的化学方程式为_______。
(4)符合下列条件的D的同分异构体共有_______种。
A.属于芳香族化合物 B.既能发生银镜反应又能发生水解反应
写出其中核磁共振氢谱图中峰面积之比为6∶2∶1∶1的同分异构体的结构简式:______。(任写一种)
(5)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以烃A为原料合成邻氨基苯甲酸(![]() )合成路线(无机试剂任选)。_______
)合成路线(无机试剂任选)。_______
【答案】甲苯 氯原子或-Cl C7H7O3N 取代反应或硝化反应 保护(酚)羟基不被氧化 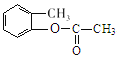 +2NaOH
+2NaOH![]() +CH3COONa+H2O 14
+CH3COONa+H2O 14 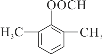 或
或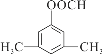
![]()
【解析】
H的结构简式为![]() ,逆推可知G为
,逆推可知G为![]() 。纵观整个过程,可知烃A为芳香烃,结合C的分子式C7H8O,可知A为
。纵观整个过程,可知烃A为芳香烃,结合C的分子式C7H8O,可知A为![]() ,A与Cl2发生苯环上氯代反应生成B,B中氯原子发生水解反应、酸化引入-OH生成C,C中酚羟基发生信息①中取代反应生成D,D与酸性KMnO4溶液反应,D中-CH3被氧化成-COOH生成E,E→F转化中在苯环上引入硝基-NO2,F→G的转化重新引入酚羟基,可知C→D的转化目的防止酚羟基被氧化,结合H的结构简式,可推知B为
,A与Cl2发生苯环上氯代反应生成B,B中氯原子发生水解反应、酸化引入-OH生成C,C中酚羟基发生信息①中取代反应生成D,D与酸性KMnO4溶液反应,D中-CH3被氧化成-COOH生成E,E→F转化中在苯环上引入硝基-NO2,F→G的转化重新引入酚羟基,可知C→D的转化目的防止酚羟基被氧化,结合H的结构简式,可推知B为![]() 、C为
、C为![]() 、D为
、D为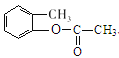 、E为
、E为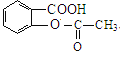 、F为
、F为![]() 。
。
(5)甲基氧化引入羧基,硝基还原引入氨基,由于氨基易被氧化,应先把甲基氧化为羧基后再将硝基还原为氨基,结合苯环引入基团的定位规律,甲苯先和浓硝酸发生取代反应生成邻硝基甲苯,然后邻硝基甲苯再被酸性高锰酸钾溶液氧化生成邻硝基苯甲酸,最后邻硝基苯甲酸和Fe、HCl反应生成邻氨基苯甲酸。
根据上述分析可知:A为![]() ,B为
,B为![]() 、C为
、C为![]() 、D为
、D为 、E为
、E为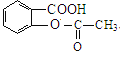 、F为
、F为![]() ,G为
,G为![]() ,H为
,H为![]() 。
。
(1)烃A为![]() ,A的名称为甲苯。B为
,A的名称为甲苯。B为![]() ,B中官能团为氯原子。H的结构简式为
,B中官能团为氯原子。H的结构简式为![]() ,H的分子式为C7H7O3N。反应②是苯环上引入硝基,反应类型是:取代反应;
,H的分子式为C7H7O3N。反应②是苯环上引入硝基,反应类型是:取代反应;
(2)C→D中消除酚羟基,F→G中又重新引入酚羟基,而酚羟基容易被氧化,所以流程中设计C→D的目的是:保护(酚)羟基不被氧化;
(3)D是 ,D与足量NaOH溶液发生酯的水解反应,化学方程式为:
,D与足量NaOH溶液发生酯的水解反应,化学方程式为: +2NaOH
+2NaOH![]() +CH3COONa+H2O,
+CH3COONa+H2O,
(4)D为 ,其符合下列条件的同分异构体:A.属于芳香族化合物,说明含有苯环;B.既能发生银镜反应又能发生水解反应,说明含有-OOCH基团。只有1个取代基为-CH2CH2OOCH和-CH(CH3)OOCH两种不同结构;有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-OOCH,这两种情况均有邻、间、对3种位置结构,种类数为2×3=6种;有3个取代基为-CH3、-CH3、-OOCH,2个甲基有邻、间、对3种位置结构,对应的-OOCH分别有2种、3种、1种位置,故符合条件的共有2+3×2+2+3+1=14种。其中核磁共振氢谱图中峰面积之比为6:2:1:1的同分异构体的结构简式:
,其符合下列条件的同分异构体:A.属于芳香族化合物,说明含有苯环;B.既能发生银镜反应又能发生水解反应,说明含有-OOCH基团。只有1个取代基为-CH2CH2OOCH和-CH(CH3)OOCH两种不同结构;有2个取代基为-CH3、-CH2COOH,或者-CH2CH3、-OOCH,这两种情况均有邻、间、对3种位置结构,种类数为2×3=6种;有3个取代基为-CH3、-CH3、-OOCH,2个甲基有邻、间、对3种位置结构,对应的-OOCH分别有2种、3种、1种位置,故符合条件的共有2+3×2+2+3+1=14种。其中核磁共振氢谱图中峰面积之比为6:2:1:1的同分异构体的结构简式: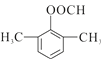 或
或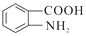 。
。
(5)以甲苯为原料合成![]() 的方法是:先使甲苯发生取代反应产生邻硝基甲苯,用酸性KMnO4氧化甲基为—COOH,得到邻硝基甲苯,用Fe在HCl存在条件下发生还原反应,—NO2被还原得到—NH2,就生成邻氨基苯甲酸。故合成路线流程图为:
的方法是:先使甲苯发生取代反应产生邻硝基甲苯,用酸性KMnO4氧化甲基为—COOH,得到邻硝基甲苯,用Fe在HCl存在条件下发生还原反应,—NO2被还原得到—NH2,就生成邻氨基苯甲酸。故合成路线流程图为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
CH3OH(g)ΔH=akJ/mol下,表所列数据是反应在不同温度下的化学平衡常数(Kc)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)写出该反应的压强平衡常数的表达式Kp______。
(2)判断该反应达到平衡状态的依据有_________。
A.消耗CH3OH的速率与消耗CO的速率相等 B.混合气体的平均相对分子质量不变
C.混合气体的密度不变 D.容器内气压不变
(3)根据上表数据,要同时提高CO的平衡转化率和反应速率,可采取的措施是______。
A.升温 B.充入H2 C.分离出甲醇 D.加入催化剂
(4)250℃时,将2 mol CO和一定量的H2充入2 L的密闭容器中,充分反应10min后,达到平衡时测得c(CO)=0.2mol·L-1,则以H2表示的反应速率v(H2)=_____。平衡后再向容器中加入0.1 mol CO和 0.4 mol CH3OH,则此时v正___v逆(填“>”、“<”或“=”)。
(5)CO还可以用做燃料电池的燃料。若电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,电池在650 ℃下工作时,其正极反应式:O2+ 2CO2 + 4e-=2CO32-,则负极反应式为:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三聚氰胺又名蛋白精[分子式:![]() ,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )
,相对分子质量:126]是一种低毒性化工产品.婴幼儿大量摄入可引起泌尿系统疾患。有关三聚氰胺的下列说法正确的是( )
A.![]() 三聚氰胺含氮原子数目为
三聚氰胺含氮原子数目为![]() B.三聚氰胺含氮量约为10%
B.三聚氰胺含氮量约为10%
C.标准状况下![]() 的三聚氰胺的体积为
的三聚氰胺的体积为![]() D.三聚氰胺的摩尔质量为126
D.三聚氰胺的摩尔质量为126
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用 50mL 0.50 mol·L-1 的盐酸与 50mL 0.50 mol·L-1 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列 说法中,不正确的是( )
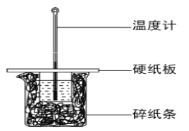
A.实验过程中有一定的热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的主要作用是固定小烧杯
D.若将盐酸体积改为 60 mL,理论上所求反应热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修5:有机化学基础]
利用化学方法合成味精的路线如下图所示:
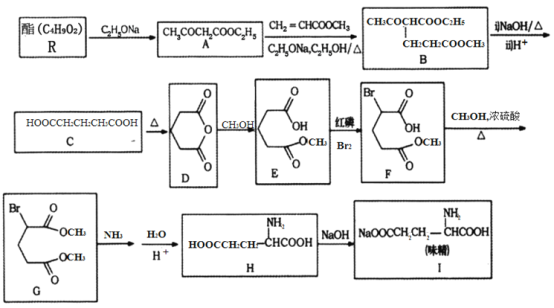
请回答以下问题:
(1)R的结构简式为________;由A生成B的反应类型是________。
(2)F中含氧官能团的名称为________;化合物H的化学名称为________________。
(3)写出由C生成D的化学方程式________________。
(4)写出一种符合下列要求的A的同分异构体的结构简式________。
①结构中含有六元环,光谱测定显示,分子结构中不存在甲基;
②能在NaOH溶液中发生水解反应;
③1mol该物质与足量金属Na反应能够生成0.5mol H2
(5)参照上述合成路线,写出以苯丙酸(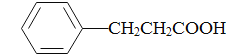 )和甲醇(其它无机试剂任选),设计合成苯丙氨酸(
)和甲醇(其它无机试剂任选),设计合成苯丙氨酸(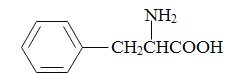 )的路线。_______________________________________________________________________
)的路线。_______________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常数为 K1,反应 Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常数为 K2;在不同温度时 K1、K2 的值如表:
700℃ | 900℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
(1) 反应 CO2(g)+H2(g)CO(g)+H2O(g)的反应热为△H ,平衡常数为 K,则△H= ____________(用△H1 和△H2 表 示), K= _______________ (用 K1 和 K2 表示),且由上述计算可知,反应CO2(g)+H2(g)CO(g)+H2O(g)是______________________________反应(填“吸热”或“放热”)。
(2) 现有反应:mA(g)+nB(g) pC(g)达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为反应___________(填“吸热”或“放热”,且 m+n___p(填“>"“=或“<”)
②减压使容器容积增大时,A的质量分数____________(填“增大”“减小”或“不变”,下同)。
③若容积不变加入B,则A的转化率_______________, B的转化率 ______________
④ 若加入催化剂,平衡时气体混合物的总物质的量____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中一定正确的是![]()
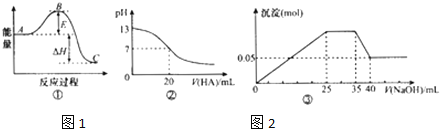
A.若图![]() 中曲线表示
中曲线表示![]() ,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
B.图![]() 可表示
可表示![]() 时,用
时,用![]() 的
的![]() 溶液滴定20mL
溶液滴定20mL![]() NaOH溶液,溶液的pH随加入的酸的体积的变化情况
NaOH溶液,溶液的pH随加入的酸的体积的变化情况
C.若图![]() 表示向含
表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为![]()
D.若图![]() 表示向含
表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则![]() :
:![]()
![]() :
:![]() :3:2
:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO3- >I2 |
B | 淀粉溶液在硫酸存在下加热一段时间后,再与新制的Cu(OH)2悬浊液混合,加热煮沸 | 无红色沉淀生成 | 淀粉没有水解 |
C | 常温下,向等体积、等浓度的NaHCO3和CH3COONa溶液中分别滴加2滴酚酞 | 两份溶液均变红,NaHCO3溶液红色更深 | 常温下的水解平衡常数:Kh(CH3COO-)<Kh(HCO3-) |
D | 常温时,用两支试管各取5 mL 0.1 mol/L 酸性KMnO4溶液,分别加入0.1 mol/L和0.2 mol/L H2C2O4溶液各2 mL | 两试管溶液均褪色,且加0.2 mol/L H2C2O4溶液的试管中褪色更快 | 其它条件不变,H2C2O4溶液的浓度越大,化学反应速率越大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | C | N | O | F | Ne | |||
3 | Na | Al | P | S | Cl |
(1)单质的化学性质最不活沷的元素是__________;
(2)氧的原子结构示意图是__________;
(3)形成化合物种类最多的元素是__________;
(4)HF和H2O中,热稳定性较强的是__________;
(5)N和P中,原子半径较小的是__________;
(6)常温下,会在浓硫酸中发生钝化的金属是_________;
(7)元素最高价氧化物对应水化物中,碱性最强的是___(填化学式),酸性最强的是_____(填“H2SO4”或“ HClO4”);
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com