
����Ŀ�������л���ĺϳ�·���У���֪��
��AΪ����������ͼ��������Է�������Ϊ92��������ױ���������û��̼̼˫�����˴Ź���������ʾA��4��壬������֮��Ϊ3��2��2��1
��E��һ��������H2������ܶ�Ϊ14������ԭ�Ӿ���һ��ƽ���ڡ�
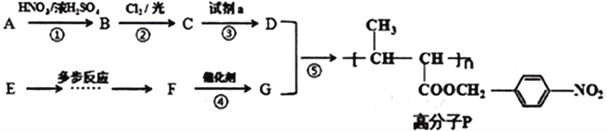
�������Ϻϳ�·�ش��������⣺
��1��A���ʵ�����____________________��������е��Լ�a��������_______________________��
��2����Ӧ�ڵĻ�ѧ����ʽ��________________________________��
��3��F�ķ���ʽ��C4H6O2��F�к��еĹ�����������__________________________________��
��4����Ӧ�ٵ�����__________________________________��
��5����Ӧ�ݵĻ�ѧ����ʽ��__________________________________��
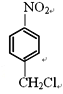
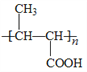
��6����D������ͬ�ķ���ʽ��������(��NO2)�ұ�����������ȡ������ͬ���칹�廹��________�֣�D���⣩��
��7����֪��![]() ����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��뷴Ӧ������______��
����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��뷴Ӧ������______��
���𰸡� �ױ� NaOHˮ��Һ ���� 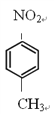 + Cl2
+ Cl2
 +HCl �Ȼ���̼̼˫�� ȡ����Ӧ����������Ӧ��
+HCl �Ȼ���̼̼˫�� ȡ����Ӧ����������Ӧ�� 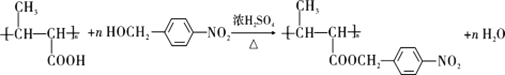 8
8 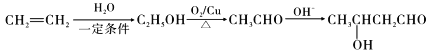
![]() CH3CH=CHCHO
CH3CH=CHCHO  CH3CH=CHCOOH
CH3CH=CHCOOH
����������AΪ����������ͼ��������Է�������Ϊ92�������෨�÷���ʽΪC7H8��������ױ���������û��̼̼˫�����˴Ź���������ʾA��4��壬������֮��Ϊ3��2��2��1����AΪ�ױ�����E��һ��������H2������ܶ�Ϊ14������Է�������Ϊ28������ԭ�Ӿ���һ��ƽ���ڣ�EΪ��ϩ��������ͼ��AΪ�ױ� ����Ũ�������£�����ΪB��BΪ
����Ũ�������£�����ΪB��BΪ![]() ��B�ڹ��������£�����ȡ����Ӧ����C��CΪ
��B�ڹ��������£�����ȡ����Ӧ����C��CΪ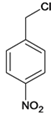 ����NaOHˮ��Һ�����������£�ˮ������D��DΪ
����NaOHˮ��Һ�����������£�ˮ������D��DΪ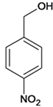 ����P��֪G�Ľṹ��ʽΪ
����P��֪G�Ľṹ��ʽΪ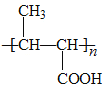 ����FΪ
����FΪ![]() ��
�� ��
��![]() ��ˮ��������
��ˮ��������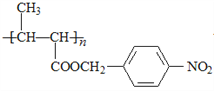 ��
��
��1��A���ʵ����Ƽױ���±ԭ���ڼ���������ˮ�����ɴ���������е��Լ�a�������� NaOHˮ��Һ�����ȣ���2����Ӧ�ڵĻ�ѧ����ʽ�� ![]() + Cl2
+ Cl2![]()
![]() +HCl ����3��F�ķ���ʽ��C4H6O2���ṹʽΪ
+HCl ����3��F�ķ���ʽ��C4H6O2���ṹʽΪ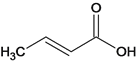 ��F�к��еĹ������������Ȼ���̼̼˫������4����Ӧ�ټױ�
��F�к��еĹ������������Ȼ���̼̼˫������4����Ӧ�ټױ�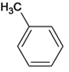 ����Ũ�������£���������
����Ũ�������£���������![]() ����Ӧ�ٵ�����ȡ����Ӧ����������Ӧ������5�����봼����������Ӧ��
����Ӧ�ٵ�����ȡ����Ӧ����������Ӧ������5�����봼����������Ӧ�� ��
��![]() ��ˮ��������
��ˮ�������� ����Ӧ�ݵĻ�ѧ����ʽ��
����Ӧ�ݵĻ�ѧ����ʽ�� ����6���������⣬�������ԭ�������������Σ���-OH��-CH2NO2��-OCH3��-NO2��-CH2OH��-NO2��ÿ�������ڱ��������ڡ��䡢������ͬ���칹�壬��D������ͬ�ķ���ʽ��������(��NO2)�ұ�����������ȡ������ͬ���칹�廹��8�֣���7����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F������ϩ��ˮ�ӳ������Ҵ����Ҵ�����������ȩ���������Ϣ��֪��ȩ������Ӧ����
����6���������⣬�������ԭ�������������Σ���-OH��-CH2NO2��-OCH3��-NO2��-CH2OH��-NO2��ÿ�������ڱ��������ڡ��䡢������ͬ���칹�壬��D������ͬ�ķ���ʽ��������(��NO2)�ұ�����������ȡ������ͬ���칹�廹��8�֣���7����EΪ��ʼԭ�ϣ�ѡ�ñ�Ҫ�����Լ��ϳ�F������ϩ��ˮ�ӳ������Ҵ����Ҵ�����������ȩ���������Ϣ��֪��ȩ������Ӧ���� ���ٷ�����ȥ��Ӧ�����������Ӧ����
���ٷ�����ȥ��Ӧ�����������Ӧ����![]() ����
����![]() �����Ժϳ�·��Ϊ��
�����Ժϳ�·��Ϊ��![]()
![]() CH3CH=CHCHO
CH3CH=CHCHO ![]() CH3CH=CHCOOH��
CH3CH=CHCOOH��


 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ��һ�ֳ����Լ����磺��������������ͭ��֤��ȩ�Ļ�ԭ�ԡ�
(1)����������ͭ����Һ�����ƣ����Թ������10%��������ͭ��Һ2mL������2%������ͭ��Һ4��6�Σ�������������Ŀ����________________________��
(2)������ij�о���ѧϰС�鿪չ��̽����ѧϰ���
������⣺�ԡ���ȩ������������ͭ����Һ��Ӧ���ɵĺ�ɫ������Cu2O��������ɣ�������Ϊ��ɫ������һ����������ͭ��Ϊ��ȷ����ɫ�����ijɷ֣�����������̽����
������룺________________________��
�������ϣ���������ͭ���ڼ��������
�ڣ�1�۵�ͭ������������������������������ԭ��Ӧ��
���ڿ���������������ͭ��������ͭ��
��Ʒ�����
����1��ȡ�ú�ɫ������������ϡ�����У��۲���Һ��ɫ�仯��
����2��ȡ�ú�ɫ��������������ϡ�����У��۲��Ƿ��в�����
����3����ȡ�ú�ɫ����ag���ڿ����г����������ȫ��ڣ����ڸ���������ȴ���ٳ�����������Σ�ֱ��������أ��Ƶ�����Ϊbg���Ƚ�a��b�Ĵ�С��
����4��ȡ��ɫ�������ڴ��Թ�������ữ����������Һ���۲��Ƿ�������ɫ����������
����Ϊ�����ķ�����____________��
(3)��������Ϊ11.6%��ij����һԪȩˮ��Һ5g�����������Ƶ�Cu(OH)2����Һ��Ӧ������Cu2O1.44g������ȩ��________���ṹ��ʽΪ________��������������Cu(OH)2����Һ��Ӧ�Ļ�ѧ����ʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ʦΪ������������Ʒ�Ӧ���������ͼװ��������������صĿα�ʵ�顣�������ڷ�һ��ƶ�����Ľ�����(������ú��)��������β����һ�Ž���NaOH��Һ�������ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ����ɴ������̡����������������(����)

A. ��Ӧ���ɵĴ����������Ȼ��ƾ���
B. ����NaOH��Һ�������������չ�������������������Ⱦ����
C. ���Ż�ȼ�ղ�����ɫ����
D. ���������ص�һ��ʯ����Һ���ж������Ƿ�Һ��ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ���Ʊ�������Cl2�����ʡ�����˵����ȷ����(����)

A. ��ͼ����MnO2��������Ũ�����ȫ��������
B. ��ͼ��֤��������ˮ�������Ժ�Ư����
C. ��ͼ���������ػ�ɫ����
D. ��ͼ����ɫ��������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ��ˮ��������Ե��ǣ� ��
A. CH3COOH B. Na2CO3
C. NaHSO4 D. NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������γɶ������ӣ���N3����NH2����N3����NH4����N2H5���ȡ���֪N2H5�����ӵ��γɹ�������NH4�����γɹ��̣�N2H5���ڼ�����Һ�����ɵ����Եķ��Ӻ�ˮ������д���пհס�
��1���õ����Է��ӵĻ�ѧʽΪ________________________��
��2��N2H5�����ӵĵ���ʽΪ______________________��
��3��д�������ɶ�ԭ����ɵĺ�����N3����������ͬ�ķ��ӵĻ�ѧʽ_______��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̶��ݻ�Ϊ2L���ܱ������з�����ӦxA��g��+yB��g��![]() zC��g����ͼI��ʾt��ʱ�����и����ʵ�����ʱ��ı仯��ϵ��ͼII��ʾƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ�����ͼ���жϣ����н�����ȷ����
zC��g����ͼI��ʾt��ʱ�����и����ʵ�����ʱ��ı仯��ϵ��ͼII��ʾƽ�ⳣ��K���¶ȱ仯�Ĺ�ϵ�����ͼ���жϣ����н�����ȷ����
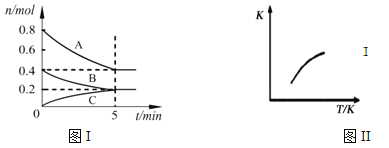
A. �÷�Ӧ�ɱ�ʾΪ��2A��g��+B��g��![]() C��g����H��0
C��g����H��0
B. t��ʱ�÷�Ӧ��ƽ�ⳣ��K=6.25
C. �������������ܶȲ��ٱ仯ʱ���÷�Ӧ�ﵽƽ��״̬
D. t�����ڵ�6 minʱ������ϵ�г���0.4 mol C���ٴδﵽƽ��ʱC�������������0.25
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������б仯�У���Ҫ������ʵ�����������ʵ�ֵ��ǣ� ��
A.KMnO4��O2
B.CO 2��CO
C.Fe2O 3��Fe
D.Br��Br2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com