
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )

A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水具有酸性和漂白性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:有色布条均褪色
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 糖类化合物都具有相同的官能团 B. 酯类物质是形成水果香味的主要成分
C. 油脂的皂化反应生成脂肪酸和丙醇 D. 蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油经过分馏及裂化等工序得到的物质均为纯净物
B. 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
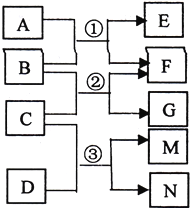
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
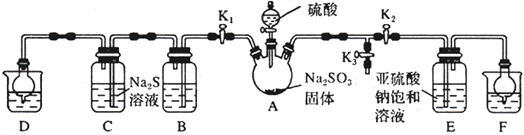
(1)向A中滴加的硫酸最好选用__________________(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为__________________________。
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有__________溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是_____________________________________;观察到装置C 中发生的现象是__________________________。
(5)装置D和F 的作用为__________________________。
(6)设计实验验证Na2S2O5晶体在空气中已被氧化:__________________________。
(7)请指出该设计的缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机物的合成路线中,已知:
①A为烃类化合物,质谱图表明其相对分子质量为92,红外光谱表明分子中没有碳碳双键,核磁共振氢谱显示A有4组峰,其峰面积之比为3∶2∶2∶1
②E是一种烃,对H2的相对密度为14,所有原子均在一个平面内。
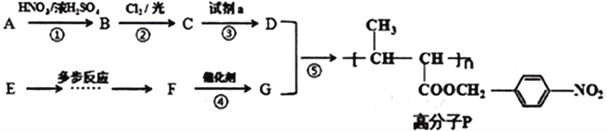
根据以上合成路线回答下列问题:
(1)A物质的名称____________________,步骤③中的试剂a及条件是_______________________。
(2)反应②的化学方程式是________________________________。
(3)F的分子式是C4H6O2,F中含有的官能团名称是__________________________________。
(4)反应①的类型__________________________________。
(5)反应⑤的化学方程式是__________________________________。
(6)与D具有相同的分子式,含硝基(—NO2)且苯环上有两个取代基的同分异构体还有________种(D除外)。
(7)已知:![]() ,以E为起始原料,选用必要的无机试剂合成F,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂与反应条件)______。
,以E为起始原料,选用必要的无机试剂合成F,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂与反应条件)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右图所示,其中A、B为多孔材料.下列说法正确的是
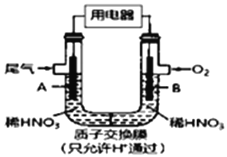
A. 该电池工作时,电子的流向:外电路由B到A
B. 电极B 附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O= NO3-+4H+
D. 该电池工作时,除去含1molNO和NO2的混合尾气,需消耗11.2LO2(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是原子序数依次递增的短周期元素,周期表中b与c、c与d相邻;b与f的最外层电子数之比为2:3,c的最外层电子数比f的最外层电子数少1个;常见化合物e2d2与水反应生成d的单质;a与d两元素只能形成两种化合物,电子数分别为10和18个。
(1)b、c、d氢化物稳定性顺序为(用分子式表示)______<______<______;
(2)由4个a原子、2个c、3个d原子组成化合物Z,则Z中的化学键类型为______;
(3)bc-离子的电子式为____________;
(4)一定量的e2d2与bd2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则该固体物质的组成为_______mol Na2O2、________mol Na2CO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com