
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
【答案】  、
、  SiF4、H2O SiO2
SiF4、H2O SiO2 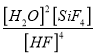 a、d b、c 0.0010mol/(L min)
a、d b、c 0.0010mol/(L min)
【解析】(1)本题考查化学用语,H2O为共价化合物,其电子式为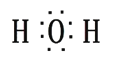 ,Si与四个F形成共价键,即结构式为
,Si与四个F形成共价键,即结构式为 ;(2)本题考查勒夏特列原理、化学平衡常数,根据信息,地壳内每增加1km,压强增大约25000-30000kPa,地壳中压强增大,根据勒夏特列原理,增大压强,此反应的平衡向正反应方向移动,即地壳中容易有气体SiF4和H2O逸出,地壳浅处,压强减小,平衡向逆反应方向移动,因此地壳浅处容易有SiO2沉积,根据平衡常数的定义,则该反应的平衡常数K=
;(2)本题考查勒夏特列原理、化学平衡常数,根据信息,地壳内每增加1km,压强增大约25000-30000kPa,地壳中压强增大,根据勒夏特列原理,增大压强,此反应的平衡向正反应方向移动,即地壳中容易有气体SiF4和H2O逸出,地壳浅处,压强减小,平衡向逆反应方向移动,因此地壳浅处容易有SiO2沉积,根据平衡常数的定义,则该反应的平衡常数K= 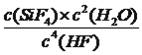 ,a、根据化学平衡常数的定义,K值变大,说明平衡向正反应方向移动,故a正确;b、化学平衡常数只受温度影响,此反应是放热反应,K值变大,说明改变的因素是降低温度,降低温度,化学反应速率降低,降低温度,化学平衡向正反应方向移动,逆反应速率又增大,故b错误;c、根据a选项分析,故c错误;d、根据b选项分析,故d正确;(3)考查化学平衡状态的判断,a、用不同物质的化学反应速率表示反应达到平衡,要求反应反应一正一逆,且反应速率之比等于化学计量数之比,即v正(HF)=2v逆(H2O),故a错误;b、根据a选项分析,v正(H2O)=2v逆(SiF4),故b正确;c、根据化学平衡状态的定义,SiO2的质量保持不变,说明反应达到平衡,故c正确;d、化学平衡是动态平衡,故d错误;(4)考查化学反应速率的计算,,根据反应方程式,1molSiO2完全反应,气体质量增加的是SiO2的量,即60g,容器内气体的密度增大0.12g·L-1,气体质量增加0.12×2g=0.24g,消耗HF的物质的量为0.24×4/60mol=0.016mol,根据化学反应速率的数学表达式v(HF)=0.016/(2×8)mol/(L·min)=0.0010 mol/(L·min)。
,a、根据化学平衡常数的定义,K值变大,说明平衡向正反应方向移动,故a正确;b、化学平衡常数只受温度影响,此反应是放热反应,K值变大,说明改变的因素是降低温度,降低温度,化学反应速率降低,降低温度,化学平衡向正反应方向移动,逆反应速率又增大,故b错误;c、根据a选项分析,故c错误;d、根据b选项分析,故d正确;(3)考查化学平衡状态的判断,a、用不同物质的化学反应速率表示反应达到平衡,要求反应反应一正一逆,且反应速率之比等于化学计量数之比,即v正(HF)=2v逆(H2O),故a错误;b、根据a选项分析,v正(H2O)=2v逆(SiF4),故b正确;c、根据化学平衡状态的定义,SiO2的质量保持不变,说明反应达到平衡,故c正确;d、化学平衡是动态平衡,故d错误;(4)考查化学反应速率的计算,,根据反应方程式,1molSiO2完全反应,气体质量增加的是SiO2的量,即60g,容器内气体的密度增大0.12g·L-1,气体质量增加0.12×2g=0.24g,消耗HF的物质的量为0.24×4/60mol=0.016mol,根据化学反应速率的数学表达式v(HF)=0.016/(2×8)mol/(L·min)=0.0010 mol/(L·min)。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A.漂白粉能漂白是因为Ca(ClO)2中的 ClO-有强氧化性B.明矾能够杀菌消毒是利用了胶体的吸附性
C.碳酸镁、小苏打等可用于治疗胃酸过多D.二氧化硅可用于制造光导纤维
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )

A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水具有酸性和漂白性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:有色布条均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+等。已知N2H5+离子的形成过程类似NH4+的形成过程,N2H5+在碱性溶液中生成电中性的分子和水,试填写下列空白。
(1)该电中性分子的化学式为________________________。
(2)N2H5+离子的电子式为______________________。
(3)写出两种由多原子组成的含有与N3-电子数相同的分子的化学式_______、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酯I的合成路线如下:

已知以下信息:
①A~I均为芳香族化合物,B苯环上只有一个取代基,且B能发生银镜反应;D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]() ③
③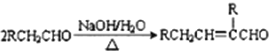
请回答下列问题:
(1)A→B的反应类型为____________,G中所含官能团的名称有____________________,E的名称是______________________________。
(2)B与银氨溶液反应的化学方程式为______________________________。
(3)I的结构简式为______________________________。
(4)符合下列要求A的同分异构体还有_______________种。
①与Na反应并产生H2 ②芳香族化合物
(5)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)。合成路线流程图示如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是
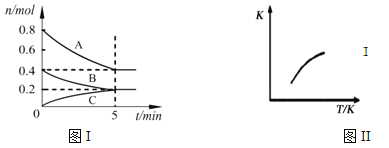
A. 该反应可表示为:2A(g)+B(g)![]() C(g)ΔH﹤0
C(g)ΔH﹤0
B. t℃时该反应的平衡常数K=6.25
C. 当容器中气体密度不再变化时,该反应达到平衡状态
D. t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用离子方程式解释下列问题
(1)A12S3为什么不能用Na2S溶液和A1C13溶液制备_____________________________________。
(2)泡沫灭火器原理_____________________________________。
(3)氯化铁溶液蒸干并灼烧的产物是________________________,原因是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年中国药学家屠呦呦获得诺贝尔医学奖,以表彰她在青蒿素研究方面做出的突出贡献。提取青蒿素通常可以用乙醚浸取,这与下列哪种方法的原理相同
A.蒸馏法B.过滤法C.结晶法D.萃取法
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com