
【题目】下列属于弱电解质的是
A. 氨水 B. 麦芽糖 C. 干冰 D. 碳酸
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油经过分馏及裂化等工序得到的物质均为纯净物
B. 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右图所示,其中A、B为多孔材料.下列说法正确的是
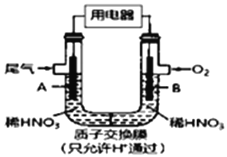
A. 该电池工作时,电子的流向:外电路由B到A
B. 电极B 附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O= NO3-+4H+
D. 该电池工作时,除去含1molNO和NO2的混合尾气,需消耗11.2LO2(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和乙烷的说法中错误的是
A.乙烯是不饱和烃,乙烷是饱和烃
B.乙烯能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,乙烷则不能
C.乙烯分子中碳碳双键的键能是乙烷分子中碳碳单键键能的两倍,因此乙烯比乙烷稳定
D.乙烯分子为平面结构,乙烷分子为立体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是
A.乙醇能燃烧
B.1molCH3CH2OH与Na完全反应只生成0.5molH2
C.乙醇分子中含有一个氧原子
D.乙醇能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:

已知
①![]()
②![]()
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为___________。
F中只有一种化学环境的氢原子,其结构简式为_________________。
G中只有一种官能团,F→G的反应类型为___________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为________________。C中含氧官能团的结构简式为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备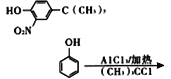 的合成路线(其他试剂任选);____________________
的合成路线(其他试剂任选);____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是原子序数依次递增的短周期元素,周期表中b与c、c与d相邻;b与f的最外层电子数之比为2:3,c的最外层电子数比f的最外层电子数少1个;常见化合物e2d2与水反应生成d的单质;a与d两元素只能形成两种化合物,电子数分别为10和18个。
(1)b、c、d氢化物稳定性顺序为(用分子式表示)______<______<______;
(2)由4个a原子、2个c、3个d原子组成化合物Z,则Z中的化学键类型为______;
(3)bc-离子的电子式为____________;
(4)一定量的e2d2与bd2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则该固体物质的组成为_______mol Na2O2、________mol Na2CO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图22所示。下列判断正确的是( )

A. 往平衡体系中加入金属铅后,c(Pb2+)增大
B. 往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C. 升高温度,平衡体系中c(Pb2+)增大,说明该反应ΔH>0
D. 25 ℃时,该反应的平衡常数K=2.2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com