
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右图所示,其中A、B为多孔材料.下列说法正确的是
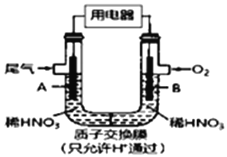
A. 该电池工作时,电子的流向:外电路由B到A
B. 电极B 附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O= NO3-+4H+
D. 该电池工作时,除去含1molNO和NO2的混合尾气,需消耗11.2LO2(标准状况下)
【答案】C
【解析】A项,由题意,该装置为原电池,通入汽车尾气(NO、NO2)的A极为负极,通入氧气的B极为正极,原电池中电子经外电路由负极流向正极,即该电池工作时,电子的流向:外电路由A到B,故A错误;B项,汽车尾气(NO、NO2)在A电极(负极)发生氧化反应生成NO3-,所以电极A附近的HNO3浓度增大,故B错误;C项,NO、NO2在A电极(负极)失电子发生氧化反应生成NO3-,根据电荷守恒、原子守恒及电解质溶液酸碱性可得电极反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O=NO3-+4H+,故C正确;D项,正极反应为:O2+4H++4e-=2H2O,结合C项中的负极反应,根据电子守恒,1molNO2反应消耗![]() molO2,标准状况下为5.6L,1molNO反应消耗
molO2,标准状况下为5.6L,1molNO反应消耗![]() molO2,标准状况下为16.8L,因为不确定1molNO和NO2的混合尾气中NO和NO2的物质的量,所以无法准确计算消耗的氧气,故D错误。
molO2,标准状况下为16.8L,因为不确定1molNO和NO2的混合尾气中NO和NO2的物质的量,所以无法准确计算消耗的氧气,故D错误。


科目:高中化学 来源: 题型:
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) ΔH>0。请回答下列问题:
P(g)+Q(g) ΔH>0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为c(M)=1 mol·L-1,c(N)=2.4 mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为________;该温度时的平衡常数K=________。
(2)若反应温度升高,则M的转化率________(填“增大”“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(M)=4 mol·L-1,c(N)=a mol·L-1,达到平衡后,c(P)=2 mol·L-1,则a=________。
(4)若反应温度不变,反应物的起始浓度为c(M)=c(N)=b mol·L-1,达到平衡后,M的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
A. 反应过程中,气体的密度始终不变
B. 当容器中气体压强不变时,反应达到平衡状态
C. 当2v正(X)=v逆(Z)时,反应达平衡状态
D. 升高温度,v(正)增大、v(逆)减小,平衡向正反应移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )

A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水具有酸性和漂白性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:有色布条均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
Ⅰ.(1)写出N的化学式和B的名称:N________,B________。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目________________。
(3)写出反应③的离子方程式____________________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液 ③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为________。
A.②③④① B.③④②①
C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及的反应类型是________。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是_____。
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有________性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?________(填“甲”或“乙”),理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-、NH2-、N3-、NH4+、N2H5+等。已知N2H5+离子的形成过程类似NH4+的形成过程,N2H5+在碱性溶液中生成电中性的分子和水,试填写下列空白。
(1)该电中性分子的化学式为________________________。
(2)N2H5+离子的电子式为______________________。
(3)写出两种由多原子组成的含有与N3-电子数相同的分子的化学式_______、________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酯I的合成路线如下:

已知以下信息:
①A~I均为芳香族化合物,B苯环上只有一个取代基,且B能发生银镜反应;D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]() ③
③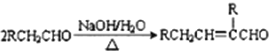
请回答下列问题:
(1)A→B的反应类型为____________,G中所含官能团的名称有____________________,E的名称是______________________________。
(2)B与银氨溶液反应的化学方程式为______________________________。
(3)I的结构简式为______________________________。
(4)符合下列要求A的同分异构体还有_______________种。
①与Na反应并产生H2 ②芳香族化合物
(5)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)。合成路线流程图示如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在如图装置中进行实验,向a中加入0.5 mol/LCuSO4溶液50 mL和5 mol/LNaOH溶液100 mL,振荡,再加入40%的甲醛溶液50 mL,缓慢加热a,在65 ℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红褐色,并有气体产生。

①仪器b的名称是_________,作用为_________。
②能说明甲醛具有还原性的实验现象是______________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物含H2不含CO,将装置A和如图所示的装置连接后进行实验。
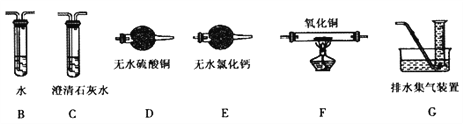
依次连接的合理顺序为A→B→___→_____→_____→_____→G,__________装置B的作用是______。
(3)已知:![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4 价,___________。
。设计实验证明a中甲醛的碳元素未被氧化成+4 价,___________。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应):
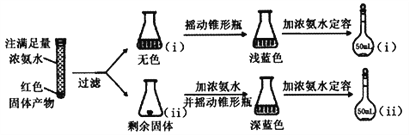
已知:Cu2O ![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+(蓝色)
[Cu(NH3)4]2+(蓝色)
①摇动锥形瓶i的目的是__________。
②锥形瓶ii中固体完全溶解得深蓝色溶液的离子方程式为_______________。
③将容量瓶ii中的溶液稀释100倍后,溶液的颜色与容量瓶i相近。由此可知固体产物的组成及物质的量之比约为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com