
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
A. 反应过程中,气体的密度始终不变
B. 当容器中气体压强不变时,反应达到平衡状态
C. 当2v正(X)=v逆(Z)时,反应达平衡状态
D. 升高温度,v(正)增大、v(逆)减小,平衡向正反应移动
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3、和FeO)得到绿矾(FeSO4·7H2O),在通过绿矾制备铁黄[FeO(OH)]的流程如下:
![]()
已知:FeS2和铁黄均难溶于水
下列说法不正确的是
A. 步骤①,最好用硫酸来溶解烧渣
B. 步骤②,涉及的离子方程式为FeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. 步骤③,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
D. 步骤④,反应条件控制不当会使铁黄中混有Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 石油经过分馏及裂化等工序得到的物质均为纯净物
B. 乙酸乙酯、油脂、葡萄糖、蛋白质均可以发生水解反应
C. 乙醇、乙酸均能与Na反应放出H2,二者分子中官能团相同
D. 苯不能使酸性高锰酸钾溶液银色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常用到化学知识,下列说法不正确的是( )
A. 白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B. 用食醋可以除去热水壶中的水垢
C. 聚氯乙烯塑料有毒,不可用于制食品包装袋
D. 新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
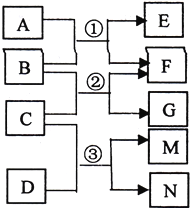
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
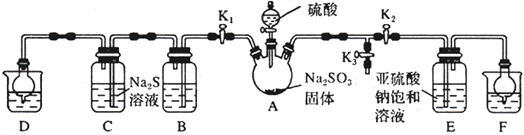
(1)向A中滴加的硫酸最好选用__________________(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为__________________________。
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有__________溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是_____________________________________;观察到装置C 中发生的现象是__________________________。
(5)装置D和F 的作用为__________________________。
(6)设计实验验证Na2S2O5晶体在空气中已被氧化:__________________________。
(7)请指出该设计的缺陷:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如右图所示,其中A、B为多孔材料.下列说法正确的是
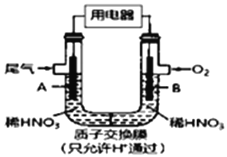
A. 该电池工作时,电子的流向:外电路由B到A
B. 电极B 附近的HNO3浓度增大
C. A电极的反应为:NO2-e-+H2O=NO3-+2H+,NO-3e-+2H2O= NO3-+4H+
D. 该电池工作时,除去含1molNO和NO2的混合尾气,需消耗11.2LO2(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:

已知
①![]()
②![]()
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为___________。
F中只有一种化学环境的氢原子,其结构简式为_________________。
G中只有一种官能团,F→G的反应类型为___________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为________________。C中含氧官能团的结构简式为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备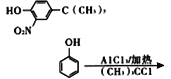 的合成路线(其他试剂任选);____________________
的合成路线(其他试剂任选);____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com