
����Ŀ��������������(��Ҫ�ɷ֣�Fe3O4��Fe2O3����FeO)�õ��̷�(FeSO4��7H2O)����ͨ���̷��Ʊ�����[FeO(OH)]����������:
![]()
��֪:FeS2�����ƾ�������ˮ
����˵������ȷ����
A. �����,������������ܽ�����
B. �����,�漰�����ӷ���ʽΪFeS2+14Fe3++8H2O=15Fe2++2SO42-+16H+
C. ����ۣ�����Һ���ȵ��н϶�����������������Ƚ�Һ�����ɣ��ɵô����̷�
D. ����ܣ���Ӧ�������Ʋ�����ʹ�����л���Fe(OH)3
 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵���У�����ȷ����( )
A.���������������Ȼ�茶���ķ�Ӧ���ڷ��ȷ�Ӧ
B.ԭ��ع���ʱ��ͨ�����·�ĵ��Ӻ��ڵ�·�����ӹ��ɻ�·
C.Ԫ�ص���������ԭ�������ĵ������������Ա仯�Ĺ��ɽ�Ԫ��������
D.��ѧ��Ӧ�ķ�Ӧ��ֻ�뷴Ӧ��ϵ��ʼ̬����̬�йأ����뷴Ӧ��;����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о������Ի�ѧ��Ӧ����Ҫ���塣Ϊ̽��������˫��ˮ�ֽ�Ĵ�Ч����ij�о�С����������ʵ�飺
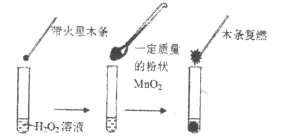
��1����ͬѧ������ͼ��ʾʵ����֤��![]() ��
��![]() �ֽⷴӦ�Ĵ�������ʵ��________����ܡ����ܡ����ﵽĿ�ģ�ԭ����___________��
�ֽⷴӦ�Ĵ�������ʵ��________����ܡ����ܡ����ﵽĿ�ģ�ԭ����___________��
��2��Ϊ̽��![]() �����Դ�Ч����Ӱ�죬��ͬѧ�ֱ���ȡ
�����Դ�Ч����Ӱ�죬��ͬѧ�ֱ���ȡ![]() 1%
1%![]() ���������У���һ��������Χ�ڣ����벻ͬ������
���������У���һ��������Χ�ڣ����벻ͬ������![]() ��������������������������£�
��������������������������£�
| 0.1 | 0.2 | 0.4 |
40sĩ | 49 | 61 | 86 |
�ɴ˵ó��Ľ�����______________��
��3������![]() ��
��![]() ��
��![]() �ֽⷴӦ�Ĵ�Ч������ͬѧ�������ʵ�飨��֧�Թ��о�ʢ��
�ֽⷴӦ�Ĵ�Ч������ͬѧ�������ʵ�飨��֧�Թ��о�ʢ��![]() ��
��
�Թ� | I | II | III |
�μ��Լ� | 5�� | 5�� | 5��0.3 |
����������� | �Ͽ����ϸС���� | ��������ϸС���� | �����ݲ��� |
������___________��ʵ��III��Ŀ����___________��
��4���ٲ������ϵ�֪������Ϊ������![]() ��Һ����
��Һ����![]() ��Һ����Һ�лᷢ������������ԭ��Ӧ����������Ӧ��
��Һ����Һ�лᷢ������������ԭ��Ӧ����������Ӧ��![]() ���μ��˷�Ӧ���Դ������ĽǶ�������������������ԭ��Ӧ�Ļ�ѧ����ʽ�ֱ���__________��___________������Ӧ������˳��д����
���μ��˷�Ӧ���Դ������ĽǶ�������������������ԭ��Ӧ�Ļ�ѧ����ʽ�ֱ���__________��___________������Ӧ������˳��д����
��������ʵ������У��ֱ������Һ���ж����̡���������һ��ͭ���ɴ˵ó�ѡ����Ϊ![]() �ֽⷴӦ�Ĵ�����Ҫ�����������___________��
�ֽⷴӦ�Ĵ�����Ҫ�����������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�Ԫ�����ʵݱ�����У��������
A.Li��Be��Bԭ��������������������B.N��O��FԪ����������ϼ���������
C.Mg��Al��Siԭ�Ӱ뾶���μ�СD.P��S��ClԪ�صĸ����ϼ�����Ϊ��3����2����1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������:Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ) ��Cr(OH)4-(��ɫ) ��Cr2O72���Ⱥ�ɫ����CrO42����ɫ������ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1����(24Cr)����________��ѡ���ţ���
a.����Ԫ�� b.����Ԫ�� c.����Ԫ�� d.����Ԫ��
��2��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c��Cr2O72����c��H+���ı仯��ͼ��ʾ��
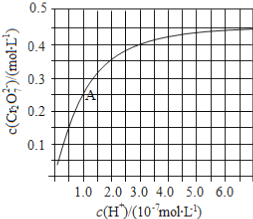
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����__________��������������С��������������������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ����H_________0������>����<������=������
��3�������ͷ�ˮ���ؽ���Ԫ�ظ��Ķ��ԣ��ɽ�Cr2O72-ת��ΪCr(OH)3������ȥ����֪��
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
ij������ˮ��������Ҫ������ͼ��ʾ��
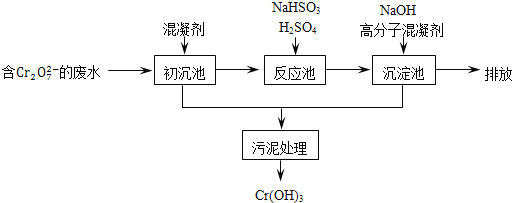
���������м���Ļ�������K2SO4�qAl2(SO4)3�q24H2O��������Ϊ__________�������ӷ���ʽ��ʾ����
����Ӧ������NaHSO3�����Է�Һ�е�Cr2O72-��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ________���������������������кͷ�����ԭ������������м���NaOH��Һ���˹����з�����Ҫ��Ӧ�����ӵ��Ⱥ�˳����____________��֤��Cr3+������ȫ�ķ�����__________��
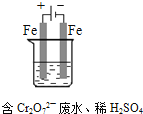
��4����ҵ���õ�ⷨ�������� Cr2O72-��ˮ��ʵ����������ͼģ�����Cr2O72-�ķ�ˮ��������Ӧʽ��Fe-2e-�TFe2+��������Ӧʽ��2H++2e-�TH2����Fe2+��������Һ�е�Cr2O72-��Ӧ�����ӷ���ʽ��__________���õ��Ľ������������������ɳ�����ȫ���õ�ⷨ��������Һ��0.01mol Cr2O72-ʱ�����ٵõ�������������__________ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ����
A. 18g2H2O�к��е�������Ϊ10NA
B. 11.2 LCl2������NaOH ��Һ��Ӧʱת�Ƶĵ�����Ϊ0.5 NA
C. 1mol��L-1��Fe2(SO4)3��Һ�к��е�SO42-��Ϊ3 NA
D. 7 g ��ϩ�Ͷ�ϩ�Ļ��������������̼ԭ������0.5 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3��SO32������ǡ�ý�2��XO4�����ӻ�ԭ����XԪ���ڻ�ԭ�����еĻ��ϼ��ǣ� ��
A.+1
B.+2
C.+3
D.+4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���淴Ӧ��M��g����N��g��![]() P��g����Q��g������H>0����ش��������⣺
P��g����Q��g������H>0����ش��������⣺
��1����ij�¶��£���Ӧ�����ʼŨ�ȷֱ�Ϊc��M����1 mol��L��1��c��N����2.4 mol��L��1���ﵽƽ���M��ת����Ϊ60%����ʱN��ת����Ϊ________�����¶�ʱ��ƽ�ⳣ��K��________��
��2������Ӧ�¶����ߣ���M��ת����________����������������С����������������
��3������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ�ȷֱ�Ϊc��M����4 mol��L��1��c��N����a mol��L��1���ﵽƽ���c��P����2 mol��L��1����a��________��
��4������Ӧ�¶Ȳ��䣬��Ӧ�����ʼŨ��Ϊc��M����c��N����b mol��L��1���ﵽƽ���M��ת����Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£����һ�����ܱ������н������¿��淴Ӧ��X(g)+Y(g) ![]() 2Z(g)+W(s)-Q(Q��0)�����������У���ȷ����
2Z(g)+W(s)-Q(Q��0)�����������У���ȷ����
A. ��Ӧ�����У�������ܶ�ʼ�ղ���
B. ������������ѹǿ����ʱ����Ӧ�ﵽƽ��״̬
C. ��2v��(X)=v��(Z)ʱ����Ӧ��ƽ��״̬
D. �����¶ȣ�v(��)����v(��)��С��ƽ��������Ӧ�ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com