
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少量Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题:
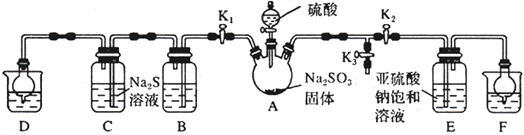
(1)向A中滴加的硫酸最好选用__________________(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是__________________________。
(3)关闭K1、K3,打开K2。一段时间后E中有Na2S2O5晶体析出,装置E中发生反应的化学方程式为__________________________。
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有__________溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是_____________________________________;观察到装置C 中发生的现象是__________________________。
(5)装置D和F 的作用为__________________________。
(6)设计实验验证Na2S2O5晶体在空气中已被氧化:__________________________。
(7)请指出该设计的缺陷:__________________________。
【答案】 B 拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔) SO2+Na2SO3=Na2S2O5 品红溶液 SO2+Br2+2H2O=2Br-+SO42-+4H+或SO2+Cl2+2H2O=2Cl-+SO42-+4H+或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+或2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(其他合理答案也给分) 有淡黄色沉淀生成 除去多余的SO2,防止污染空气 取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,再滴入BaCl2溶液,有白色沉淀生成 AB之间、AE之间没有防倒吸装置或没有排除装置内空气,防止Na2S2O5被氧化(没有防止Na2S2O5被氧化的措施)
【解析】(1)A中制备二氧化硫,A.98%的浓硫酸不利于气体的逸出,故A错误;B.70%的硫酸浓度恰到好处,故B正确;C.10%的稀硫酸浓度太低,二氧硫在其中溶解的量多,反应速度也慢,故D错误;故选B。(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是拔掉分液漏斗上口的玻璃塞(或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔);(3)装置E中发生反应的化学方程式为SO2+Na2SO3=Na2S2O5 ;(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有品红溶液溶液;若探究SO2的还原性,B中发生反应的离子方程式可以是SO2+Br2+2H2O=2Br-+SO42-+4H+或SO2+Cl2+2H2O=2Cl-+SO42-+4H+或2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+或2Fe3++SO2+2H2O=2Fe2++SO42-+4H+(其他合理答案也给分) ;观察到装置C 中发生的现象是有淡黄色沉淀生成;(5)装置D和F 的作用为除去多余的SO2,防止污染空气;(6)要设计实验验证Na2S2O5晶体在空气中已被氧化:Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可。方法:取少量Na2S2O5晶体于试管中,加适量水溶解,再滴加足量盐酸,振荡,再滴入BaCl2溶液,有白色沉淀生成。(7)该设计的缺陷:AB之间、AE之间没有防倒吸装置或没有排除装置内空气,防止Na2S2O5被氧化(没有防止Na2S2O5被氧化的措施)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据图示及描述,回答下列问题:

(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气?____________(填“漏气”、“不漏气”或“无法确定”),判断理由_____________。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?___________(填“漏气”、“不漏气”或“无法确定”),判断理由____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) ![]() 2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
2Z(g)+W(s)-Q(Q>0),下列叙述中,正确的是
A. 反应过程中,气体的密度始终不变
B. 当容器中气体压强不变时,反应达到平衡状态
C. 当2v正(X)=v逆(Z)时,反应达平衡状态
D. 升高温度,v(正)增大、v(逆)减小,平衡向正反应移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol·L-1HCl溶液滴定10.00mL浓度为0.1000 mol·L-1Na2CO3溶液,所得滴定曲线如图所示。已知H2CO3的Ka1=10-6.4,Ka2=10-10.2,下列说法不正确的是

A. m=11.6
B. 当V=5时,c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
C. 若用酚酞作指示剂,溶液由红色变为浅红色时,消耗盐酸体积约为10mL
D. 当V=a时c(Na+)>c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用以下装置制备并检验Cl2的性质。下列说法正确的是( )

A. Ⅰ图:若MnO2过量,则浓盐酸可全部消耗完
B. Ⅱ图:证明新制氯水具有酸性和漂白性
C. Ⅲ图:产生了棕黄色的雾
D. Ⅳ图:有色布条均褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:

请根据以上信息回答下列问题:
Ⅰ.(1)写出N的化学式和B的名称:N________,B________。
(2)写出反应②的化学方程式,并标出其电子转移的方向和数目________________。
(3)写出反应③的离子方程式____________________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用的试剂为:①盐酸 ②氯化钡溶液 ③氢氧化钠溶液④碳酸钠溶液,以上试剂添加的顺序可以为________。
A.②③④① B.③④②①
C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及的反应类型是________。
A.分解反应 B.化合反应
C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是_____。
A.从外地购买
B.在当地新建生产厂
C.从本厂生产烧碱处循环
D.从本厂生产镁单质处循环
流程⑦将溴单质从混合物中分离出来是基于溴单质具有________性。
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2
乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?________(填“甲”或“乙”),理由是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香酯I的合成路线如下:

已知以下信息:
①A~I均为芳香族化合物,B苯环上只有一个取代基,且B能发生银镜反应;D的相对分子质量比C大4,E的核磁共振氢谱有3组峰。
②![]() ③
③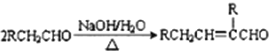
请回答下列问题:
(1)A→B的反应类型为____________,G中所含官能团的名称有____________________,E的名称是______________________________。
(2)B与银氨溶液反应的化学方程式为______________________________。
(3)I的结构简式为______________________________。
(4)符合下列要求A的同分异构体还有_______________种。
①与Na反应并产生H2 ②芳香族化合物
(5)据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任选)。合成路线流程图示如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于“摩尔”的理解不正确的是( )
A.摩尔是一个物理量
B.摩尔是物质的量的单位,简称摩,符号为mol
C.1mol12C与0.012kg12C所含碳原子数相同
D.1molO2约含6.02×1023个氧分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com