
【题目】用离子方程式解释下列问题
(1)A12S3为什么不能用Na2S溶液和A1C13溶液制备_____________________________________。
(2)泡沫灭火器原理_____________________________________。
(3)氯化铁溶液蒸干并灼烧的产物是________________________,原因是_____________________________________。
【答案】 2Al3++3S2-+6H2O =2Al(OH)3↓+3H2S↑ Al3++3HCO3-= Al(OH)3↓+3CO2↑ Fe2O3 FeCl3+3H2O![]() Fe(OH)3+3HCl,加热水解平衡右移,HCl挥发,生成Fe(OH)3,灼烧发生反应:2Fe(OH)3
Fe(OH)3+3HCl,加热水解平衡右移,HCl挥发,生成Fe(OH)3,灼烧发生反应:2Fe(OH)3![]() FeCl3+3H2O
FeCl3+3H2O
【解析】本题主要考查盐类水解。
(1)Al3+和S2-水解互促至水解完全,反应的离子方程式为Al3++3S2-+6H2O =2Al(OH)3↓+3H2S↑。
(2)泡沫灭火器中的硫酸铝溶液与碳酸氢钠溶液混合,Al3+与HCO3-水解互促至完全水解,产生大量二氧化碳气体和泡沫,覆盖在可燃物上,使可燃物与空气隔绝,达到灭火的目的。反应的离子方程式为Al3++3HCO3-= Al(OH)3↓+3CO2↑。
(3)氯化铁溶液蒸干并灼烧的产物是Fe2O3,原因是FeCl3+3H2O![]() Fe(OH)3+3HCl,加热水解平衡右移,HCl挥发,生成Fe(OH)3,灼烧发生反应:2Fe(OH)3
Fe(OH)3+3HCl,加热水解平衡右移,HCl挥发,生成Fe(OH)3,灼烧发生反应:2Fe(OH)3![]() Fe2O3+3H2O。
Fe2O3+3H2O。


科目:高中化学 来源: 题型:
【题目】已知A为常见温室气体,B为淡黄色氧化物,C为常见液体,D为黄绿色气体单质,相互反应的关系如右图所示,M的水溶液能杀菌消毒。下列有关叙述正确的是
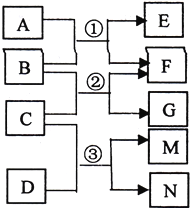
A. 4.4gA含有4.4NA个质子
B. 7.8gB与足量A发生反应①,共转移0.2NA电子
C. 反应③的离子方程式为:Cl2+H2O![]() 2H++Cl-+ ClO-
2H++Cl-+ ClO-
D. M的电子式为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界的矿物,岩石的成因和变化收到许多条件的影响。地壳内每增加1km,压强增大约25000-30000kPa。在地壳内SiO2和HF存在一下平衡:SiO2(s) +4HF(g) ![]() SiF4(g)+ 2H2O(g) +148.9kJ。
SiF4(g)+ 2H2O(g) +148.9kJ。
(1)写出H2O的电子式:___________,SiF4的结构式:____________
(2)在地壳深处容易有___________气体逸出,在地壳浅处容易有___________沉积。该反应的平衡常数表达式为:K=_______________。如果上述反应的平衡常数K值变大,该反应_______(选填编号)。
a.一定向正反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向逆反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(3)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,______(选填编号)。
a.2v正(HF)=v逆(H2O) b.v正(H2O)=2v逆(SiF4)
c.SiO2的质量保持不变 d.反应物不再转化为生成物
(4)若反应的容器容积为2.0L,反应时间8.0 min,容器内气体的密度增大了0.12 g/L,在这段时间内HF的平均反应速率为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明乙醇分子中有一个氢原子与其他氢原子不同的是
A.乙醇能燃烧
B.1molCH3CH2OH与Na完全反应只生成0.5molH2
C.乙醇分子中含有一个氧原子
D.乙醇能溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯类化合物H是一种医药中间体,常用于防晒霜中紫外线的吸收剂。实验室由化合物A和E制备H的一种合成路线如下图:

已知
①![]()
②![]()
回答下列问题:
(1)经测定E的相对分子质量为28,常用来测定有机物相对分子质量的仪器为___________。
F中只有一种化学环境的氢原子,其结构简式为_________________。
G中只有一种官能团,F→G的反应类型为___________________。
(2)(CH3)2SO4是一种酯,其名称为_________________。
(3)A能与Na2CO3溶液及浓溴水反应,且1molA最多可与2molBr2反应。核磁共振氢谱表明A的苯环上有四种不同化学环境的氢原子。A的结构简式为________________。C中含氧官能团的结构简式为_________。
(4)D+G→H的化学方程式为__________________。
(5)C的同分异构体中能同时满足下列条件的共有_____种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生水解反应
(6)参照上述合成路线,设计一条由![]() 和(CH3)3CCl为起始原料制备
和(CH3)3CCl为起始原料制备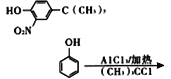 的合成路线(其他试剂任选);____________________
的合成路线(其他试剂任选);____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用氯化铜晶体(CuCl2·2H2O,含氯化亚铁杂质)制取纯净的CuCl2·2H2O。先将其制成水溶液,后按如图步骤进行提纯:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表
金属离子 | Fe3+ | Fe2+ | Cu2+ |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)现有氧化剂NaClO、H2O2、KMnO4,X加哪种好,为什么?________________________________,该反应的离子方程式为_________________________________。
(2)溶液II中除Cu2+外,还有______金属离子,检验试剂为______________。物质Y不能为下列的________________________。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3 e.CaO f.NaOH
(3)常温下,除去CuCl2溶液中的Fe2+,加入氧化剂X,使Fe2+氧化为Fe3+,然后加入物质Y至溶液pH=4,此时c(Fe3+)=_________mol/L,[已知Fe(OH)3的Ksp=4×10-38]
(4)若在空气中加热固体CuCl2·2H2O,可水解生成Cu(OH)Cl,写出相关的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f是原子序数依次递增的短周期元素,周期表中b与c、c与d相邻;b与f的最外层电子数之比为2:3,c的最外层电子数比f的最外层电子数少1个;常见化合物e2d2与水反应生成d的单质;a与d两元素只能形成两种化合物,电子数分别为10和18个。
(1)b、c、d氢化物稳定性顺序为(用分子式表示)______<______<______;
(2)由4个a原子、2个c、3个d原子组成化合物Z,则Z中的化学键类型为______;
(3)bc-离子的电子式为____________;
(4)一定量的e2d2与bd2反应后的固体物质,恰好与0.8 mol稀盐酸溶液完全反应,并收集到0.25 mol气体,则该固体物质的组成为_______mol Na2O2、________mol Na2CO3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是

A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A. -488.3 kJ·mol-1 B. -244.15 kJ·mol-1 C. +488.3 kJ·mol-1 D. +244.15 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com