
【题目】HCl+NaOH=NaCl+H2O的反应类型是
A. 化合反应 B. 置换反应 C. 分解反应 D. 复分解反应
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,甲、乙均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是
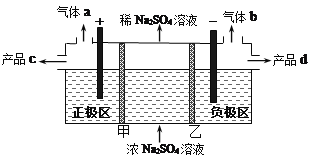
A. 甲为阳离子交换膜,通电后中间隔室的Na+离子向正极迁移
B. 通电后,同温同压下得到的气体a与气体b的体积比约为2:1
C. 通电后,得到的产品c是NaOH,产品d是H2SO4
D. 负极区发生的电极反应为2H2O +2e-=2OH-+H2↑,负极区溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬、钛及其化合物在工业上有重要用途,回答下列问题:
(1)Cr基态原子价层电子的轨道表达式(电子排布图)为_________________________。
(2)氮化铬(CrN)在超级电容器领域具有良好的应用前景,可由CrCl3·6H2O与尿素[(NH2)2CO]反应先得到配合物Cr[OC(NH2)2]6Cl3,然后在通有NH3和N2混合气体的反应炉内热分解制得。尿素构成元素中电负性由大到小的顺序为_________,中心碳原子的杂化类型为_________;Cr[OC(NH2)2]6Cl3含有的化学键类型有__________________。
(3)氮化铬的晶体结构类型与氯化钠的相同,氮化铬熔点(1282℃)比氯化钠的高,主要原因是_________________________________________。
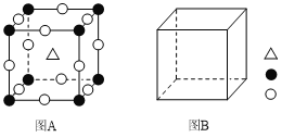
(4)钙钛矿(CaTiO3)型的结构可看作氧化物超导相结构的基本单元。
①图A为立方钙钛矿(CaTiO3)结构的晶胞,晶胞边长为a nm。Ca处于晶胞的顶点,则Ti处于_________位置,O处于_________位置;与Ca紧邻的O个数为_________,Ti与O间的最短距离为____________________nm 。
②在图B中画出立方钙钛矿晶胞结构的另一种表示(要求:Ti处于晶胞的顶点;![]() ,
,![]() ,
,![]() 所代表的原子种类与图A相同)____________________。
所代表的原子种类与图A相同)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
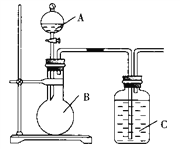
已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是___________________________
(2)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明硫的非金属性比氯的非金属性________(填“强”或“弱”或“无法判断”)。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂________________,实验现象为_________________________该装置存在不足之处,改进措施为:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是
A. 6.0gSiO2中含有0.1NA个SiO2分子
B. 标准状况下,向1L密闭容器中充入46gNO2气体,容器中的分子数为NA
C. 过氧化钠与水反应,每生成0.1mol氧气,转移电子的数目为0.4NA
D. 常温常压下,7.0g由丁烯与丙烯组成的混合物中含有氢原子的数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断裂1molH-H要吸收的能量为436kJ,形成1molH-N放出391kJ的能量,氨气的结构如图,根据化学方程式N2+3H2 ![]() 2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
2NH3,1molN2与3molH2反应时放热92kJ,则断裂1molN≡N所需要的能量为 ( )
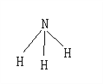
A. 431kJ B. 698kJ C. 946kJ D. 394kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中有着广泛的应用。某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体,同时得到浅绿色酸性溶液。为此,他们设计了如下装置验证所产生的气体(夹持装置省略)并进行有关实验。

(1)①若装置A中的试管不加热,则没有明显现象,原因是____________。
②证明有SO2 生成的现象是_____;为了证明气体中含有氢气,装置B和C中加入的试剂分别为X、CuSO4,请写出装置B处反应的化学方程式________________。
(2)取装置A试管中的溶液6mL,加入适量氯水恰好反应,再加入过量的KI溶液后,分别取2mL此溶液于3支小试管中进行如下实验:
①第一支试管中加入1mLCCl4,充分振荡、静置,CCl4层呈紫色;
②第二支试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有____(填离子符号),由此可以证明该离子与I-发生的氧化还原反应为_______。
(3)向盛有H202溶液的试管中加入几滴装置A试管中的溶液,溶液变成棕黄色,发生反应的离子方程式为_________________;一段时间后,溶液中有气泡出现并放热,随后有红褐色沉淀生成。产生气泡的原因是________________;生成沉淀的原因是_______________ (用平衡移动原理解释)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com