
【题目】某同学设计如图装置,研究非金属元素性质变化规律。
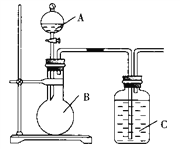
已知:高锰酸钾在常温下与浓盐酸反应产生氯气。
(1)利用如图装置证明Cl2氧化性强于I2的氧化性。则A中装浓盐酸,B中装入高锰酸钾粉末, C中装入淀粉KI溶液,则C中现象是___________________________
(2)如果C中装饱和的H2S溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察到现象是C中产生淡黄色沉淀,证明硫的非金属性比氯的非金属性________(填“强”或“弱”或“无法判断”)。
(3)现有浓硝酸、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明:非金属性:N > C > Si。C中装试剂________________,实验现象为_________________________该装置存在不足之处,改进措施为:______________________________________
【答案】 淀粉-KI溶液变蓝色 弱 硅酸钠溶液 有白色沉淀生成 在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶
【解析】(1)盐酸和高锰酸钾之间反应产生氯气,氯气将碘离子氧化为碘单质,碘单质遇到淀粉变蓝色,故答案为:淀粉-KI溶液变蓝色;
(2)装置C中装饱和氢硫酸溶液,A中装浓盐酸,B中装高锰酸钾溶液,反应开始后观察现象是C中产生淡黄色沉淀,反应的化学方程式为:Cl2+H2S═S↓+2HCl;证明硫元素比氯元素非金属性弱,故答案为:弱;
(3)现有硝酸溶液、大理石、澄清石灰水、硅酸钠溶液,选择试剂用如图装置证明非金属性:N > C > Si,即需要证明酸性:HNO3>H2CO3>H2SiO3;因此先加入硝酸和碳酸钙反应生成二氧化碳,二氧化碳通入硅酸钠溶液生成硅酸沉淀;装置C中反应是:CO2+SiO32-+H2O =H2SiO3↓+CO32-,C中装试剂硅酸钠溶液;现象为有白色沉淀生成;但是浓硝酸具有挥发性,防止硝酸和硅酸钠之间反应的干扰,所以在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶,故答案为:硅酸钠溶液;有白色沉淀生成;在B、C之间加一个盛饱和NaHCO3溶液的洗气瓶。


科目:高中化学 来源: 题型:
【题目】盛有NO和NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半.
(1)写出有关反应的化学方程式.
(2)原混合气体中NO和NO2的体积比是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
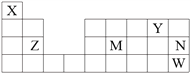
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将气体X、Y放入密闭容器中发生反应生成Z,5min后达到平衡.其初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/molL﹣1 | 0.1 | 0.2 | 0 |
平衡浓度/molL﹣1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是( )
A.该反应可表示为X+3Y2Z
B.反应达到平衡时,X的转化率为50%
C.前5min 以Y表示的平均反应速率为υ(Y)=0.01 molL﹣1min﹣1
D.增大压强使平衡向生成Z的方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于放热反应H2 + Cl2 ![]() 2HCl下列说法中正确的是
2HCl下列说法中正确的是
A. 该反应中,化学能只转变为热能
B. 反应物所具有的总能量高于产物所具有的总能量
C. 产物所具有的总能量高于反应物所具有的总能量
D. 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成2mol H-Cl键所放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2C2O4是二元弱酸,室温下向某浓度的草酸溶液中逐滴加入KOH溶液,所得溶液中H2C2O4、HC2O4-、C2O42-的组成百分率与pH的关系如图所示,下列说法正确的是
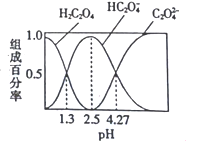
A. pH=4.27的溶液中:c(K+)+c(H+)=c(OH-)+3c(C2O42-)
B. 反应HC2O4-+H2O![]() H2C2O4+OH-的平衡常数为10-4.27
H2C2O4+OH-的平衡常数为10-4.27
C. 向溶液中加入KOH溶液将pH由1.3调至4.27的过程中水的电离程度先增大后减小
D. pH=2.5的溶液中:c(H+)+2c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4,Pb3O4与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为_____________。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:

(2) “酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4生成1molPbSO4转移电子的物质的量为____________mol。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq),其溶解度曲线如图所示:
NaHPbO2(aq),其溶解度曲线如图所示:

②粗品PbO中所含杂质不溶于NaOH溶液。
结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量__________(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,___________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HCl和NaCl的混合溶液中,得到含Na2PbCl2的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示。

①阴极的电极反应式为_______________________。
②电解一段时间后,Na2PbCl4浓度极大减小,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解,正确的是( )
A. 结构式:A=B=A,既可以表示CO2,也可以表示SiO2
B. 电子式![]() 可以表示羟基,也可以表示氢氧根离子
可以表示羟基,也可以表示氢氧根离子
C. 比例模型![]() :可以表示甲烷分子,也可以表示四氯化碳分子
:可以表示甲烷分子,也可以表示四氯化碳分子
D. 离子结构示意图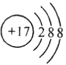 :可以表示35Cl-,也可以表示37Cl-
:可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com