
【题目】(1)实验室需要450 mL 0.02 mol/L酸性KMnO4标准溶液,现有仪器:
① 托盘天平 ② 玻璃棒 ③ 药匙 ④ 200mL烧杯 ⑤ 量筒,还需要 玻璃仪器才能完成配制,需称量KMnO4固体 g。
(2)下列操作会使配制的KMnO4溶液浓度偏大的是 (填写编号,假设其他操作均正确)。
A.没有冷却至室温就转移液体到容量瓶并完成定容 |
B.使用容量瓶配制溶液,定容时,俯视刻度线 |
C.没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中 |
D.容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液 |
E.定容时,滴加蒸馏水,不慎液面略高于刻度线,吸出少量水使凹液面最低点与刻度线相切
(3)配平下面的方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□H2C2O4+□H2SO4——□MnSO4+□K2SO4+□H2O+□CO2↑
(4)人体血液里Ca2+的浓度一般以mg/cm3为单位。为测定血液样品中Ca2+的浓度,抽取血样20.00 mL,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用上述标准0.02 mol/L 酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗13.00 mL酸性 KMnO4溶液,请计算血液样品中Ca2+的浓度为_________mg/cm3(保留到小数点后两位)。
【答案】(1)500ml容量瓶(没有500ml不得分,1分) 胶头滴管(1分) 1.6(3分)
(2)A B(2分,漏选得1分,有错选不得分)
(3)2、5、3、2、2、10、8(3分,“1”不写得1分)
(4)1.30(3分,写成“1.3”得1分)
【解析】试题分析:(1)根据大而近原则,没有450 mL容量瓶,必须选择500 mL容量瓶才能完成配液,且计算KMnO4固体的质量不能用450 × 10-3 L×0.02 mol/L×158 g/mol=1.422g≈1.4 g,而应用500 × 10-3 L×0.02 mol/L×158 g/mol=1.58g≈1.6 g;(2)A、由n/V=c、控制变量法可知,没有冷却至室温就转移液体到容量瓶并完成定容,对n无影响,但会使V变小,则c偏大,A正确;B、定容时,俯视刻度线,对n无影响,但会使V变小,则c偏大,B正确;C、没有用蒸馏水洗涤烧杯2-3次,并将溶液移入容量瓶中,对V无影响,但会使n变小,则c偏小,C错误;D、容量瓶刚用蒸馏水洗净,没有烘干就用来配制溶液,对n、V均无影响,则对c无影响,D错误;E、定容时,滴加蒸馏水,不慎液面略高于刻度线,吸出少量水使凹液面最低点与刻度线相切,对n无影响,但会使V变大,则c偏小,E错误;(3)由电子得失守恒、原子守恒配平可得:![]() ;(4)由cV=n可知,KMnO4为0.02 ×13.00 ×10-3 mol;由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+8H2O+10CO2↑可知,为0.02 ×13.00 ×10-3 ×5/2 mol;由Ca2+~CaC2O4~H2C2O4可知,Ca2+为0.02 ×13.00 ×10-3 ×5/2 mol;由nM=m可知,Ca2+为0.02 ×13.00 ×10-3 ×5/2 ×40 g =" 0.02" ×13.00 ×10-3 ×5/2 ×40 ×10mg;20.00 mL="20.00" cm3,则血液样品中Ca2+的浓度为 0.02 ×13.00 ×10-3 ×5/2 ×40 ×10/20.00 =" 1.30" mg/cm3。
;(4)由cV=n可知,KMnO4为0.02 ×13.00 ×10-3 mol;由2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+8H2O+10CO2↑可知,为0.02 ×13.00 ×10-3 ×5/2 mol;由Ca2+~CaC2O4~H2C2O4可知,Ca2+为0.02 ×13.00 ×10-3 ×5/2 mol;由nM=m可知,Ca2+为0.02 ×13.00 ×10-3 ×5/2 ×40 g =" 0.02" ×13.00 ×10-3 ×5/2 ×40 ×10mg;20.00 mL="20.00" cm3,则血液样品中Ca2+的浓度为 0.02 ×13.00 ×10-3 ×5/2 ×40 ×10/20.00 =" 1.30" mg/cm3。


科目:高中化学 来源: 题型:
【题目】在有机物分子中,不同氢原子的核磁共振谱中给出的峰值(信号)也不同,根据峰值可以确定有机物分子中氢原子的种类和数目.
①化合物M和N的分子式都是C2H4Br2,M的核磁共振氢谱图如图所示,则M的结构简式为 ,请预测N的核磁共振氢谱上有 个峰.
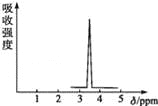
②用核磁共振氢谱的方法来研究C2H6O的结构,简要说明根据核磁共振氢谱来确定分子结构的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语错误的是 ( )
A.硫离子的核外电子排布式:1s22s22p6
B.碳原子的外围电子轨道表示式:![]()
C.碳﹣14的原子组成符号:![]() C
C
D.Cl﹣的结构示意图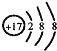
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是有关SO2、Cl2的性质实验。
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质。
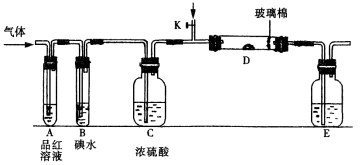
①若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同? (填“相同”或“不相同”);若D中盛铜粉,通入足量的Cl2,D中的现象是___________;若装置D中装的是五氧化二钒(催化剂),通入SO2时,打开K通入适量O2的化学反应方程式为 。
②SO2通入B中,碘水褪色,则该反应的离子方程式为 。
③E中盛有______________溶液。
某同学将足量的SO2通入一支装有氯化钡溶液的试管,未见沉淀生成,若向该试管中加入足量(填字母) ,则可以看到白色沉淀产生。
A.氨水 B.硝酸钠溶液 C.氯化钙溶液
若由元素S和O组成–2价酸根离子X,X中S和O的质量比为4∶3;当Cl2与含X的溶液完全反应后,得澄清溶液,取少量该溶液加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是合成硝酸、铵盐和氮肥的基本原料,氮的氧化物是大气的污染物,请问:
(1)氨的水溶液显弱碱性,其原因为 (用离子方程式表示),0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH (填“增大”或“减小”);若加入少量的明矾,溶液中的NH4+的浓度 (填“增大”或“减小”)。
(2)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为 ,平衡常数表达式为 ;若有1mol硝酸铵完全分解,转移的电子数为 mol。
(3)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式: 。在汽车尾气系统中装置催化转化器,可有效降低NOx的排放。当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“北京烤鸭”举世闻名.制作烤鸭套餐的部分原料如下:①鸭肉、②面粉、③黄瓜、④食盐.请回答:
(1)富含淀粉的是 (填序号,下同).
(2)富含蛋白质的是 .
(3)富含维生素的是 .
(4)属于调味剂的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的比较,不正确的是( )
A. 金属性:Al>Mg B. 稳定性:HF>HCl
C. 酸性:HClO4>H2SO4 D. 碱性:NaOH>Mg(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.光照新制的氯水时,颜色变浅,溶液的酸性增强
B.打开可乐瓶,有大量气泡从溶液中冒出
C.I2(g)+H2(g)![]() 2HI(g)的平衡体系,加压后颜色变深
2HI(g)的平衡体系,加压后颜色变深
D.高压有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的应用正确的是
A.常温下干燥氯气与铁不反应,可以用钢瓶储存氯水
B.铜的金属活泼性比铁的弱,可在铁船闸上装若干铜块以减缓其腐蚀
C.二氧化硫有漂白、杀菌性能,可在食品生产中大量使用
D.次氯酸钠具有强氧化性,可用于配制消毒液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com