
����Ŀ�����Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ������������Ǵ�������Ⱦ����ʣ�
(1)����ˮ��Һ�������ԣ���ԭ��Ϊ (�����ӷ���ʽ��ʾ)��0.1 molL-1�İ�ˮ�м���������NH4Cl���壬��Һ��pH (����������������С��)����������������������Һ�е�NH4+��Ũ�� (����������������С��)��
(2)����識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
(3)NOx���γ�����,д��NO2ת��ΪHNO3�Ļ�ѧ����ʽ: ��������β��ϵͳ��װ�ô�ת����������Ч����NOx���ŷš���β���п�������ʱ��NOx�ڴ�ת�����б���ԭ��N2�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ�� ��
���𰸡�
(1)NH3��H2O![]() NH4++OH-����������
NH4++OH-����������
(2)NH4NO3![]() N2O��+2H2O����K=c(N2O)c(H2O)2��4
N2O��+2H2O����K=c(N2O)c(H2O)2��4
(3)3NO2+H2O=2HNO3+NO��2CO+2NO![]() N2+2CO2
N2+2CO2
��������
���������(1)һˮ�ϰ�Ϊ�����ˮ��Һ�д��ڲ��ֵ��룬���������������ʹ��Һ�Լ��ԣ�����ʽΪ��NH3H2O![]() NH4++OH-����ˮ�м�������NH4Cl���壬笠�Ũ������ƽ�����ƣ���������Ũ�ȼ�С��pHֵ���ͣ�������������������������������ӽ�����������������������ٽ���ˮ�ĵ��룬笠�Ũ�����ʴ�Ϊ��NH3H2O
NH4++OH-����ˮ�м�������NH4Cl���壬笠�Ũ������ƽ�����ƣ���������Ũ�ȼ�С��pHֵ���ͣ�������������������������������ӽ�����������������������ٽ���ˮ�ĵ��룬笠�Ũ�����ʴ�Ϊ��NH3H2O![]() NH4++OH-����С������
NH4++OH-����������
(2)����立ֽ�����N2O��H2O���ﵽƽ�⣬˵��Ϊ���淴Ӧ����ѧ��Ӧ����ʽΪ��NH4NO3![]() N2O+2H2O��250��ʱ��ˮΪ����״̬����ƽ�ⳣ��K=c(N2O)��c2(H2O)��NH4NO3��NH4+��NԪ�ػ��ϼ�Ϊ-3�ۣ�NO3-�е�NԪ�صĻ��ϼ�Ϊ+5�ۣ���Ӧ��NԪ�صĻ��ϼ�Ϊ+1�ۣ��������з�Ӧ��NԪ����-3������Ϊ+1�ۣ��˷�Ӧ��ÿ�ֽ�1mol����泥�ת�Ƶ�����Ϊ4mol���ʴ�Ϊ��NH4NO3
N2O+2H2O��250��ʱ��ˮΪ����״̬����ƽ�ⳣ��K=c(N2O)��c2(H2O)��NH4NO3��NH4+��NԪ�ػ��ϼ�Ϊ-3�ۣ�NO3-�е�NԪ�صĻ��ϼ�Ϊ+5�ۣ���Ӧ��NԪ�صĻ��ϼ�Ϊ+1�ۣ��������з�Ӧ��NԪ����-3������Ϊ+1�ۣ��˷�Ӧ��ÿ�ֽ�1mol����泥�ת�Ƶ�����Ϊ4mol���ʴ�Ϊ��NH4NO3![]() N2O+2H2O��K=c(N2O)��c2(H2O)��4��
N2O+2H2O��K=c(N2O)��c2(H2O)��4��
(3)NO2��ˮ��Ӧ����HNO3�Ļ�ѧ����ʽΪ3NO2+H2O=2HNO3+NO���ڴ��������£�һ����̼���������ɶ�����̼��һ����������ԭ���ɵ����������䷴Ӧ����ʽΪ��2NO+2CO![]() 2CO2+N2���ʴ�Ϊ��3NO2+H2O=2HNO3+NO��2NO+2CO
2CO2+N2���ʴ�Ϊ��3NO2+H2O=2HNO3+NO��2NO+2CO![]() 2CO2+N2��
2CO2+N2��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ��ƿ�ʹ�����ʱ��ԣ���������ɱ��
B. ��Ȼ������������ǿ���ǿ����Һ�������Ի�����
C. ʳ�Ρ��ǡ�������ζ������������ʳƷ������
D. �������װ��п�飬�������������������������з���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ��������ᣬ�ش��������⣺
��1������ĵ��뷽��ʽ�� ��������Щ��ʩ�ܹ�ʹ������Һ��c��H+�� / c��CH3COO-�� ������� ��
a������ b��ͨ��HCl���� c������NaOH���� d������NaHSO4����
��2����100ml 0��1mol��L-1�Ĵ����м���Vml0��1mol��L-1��NaOH��Һ��ȫ��Ӧ����Һ�����ԣ���V 100ml�� �>������<����=�� ����
��3����CH3COOH��CH3COONa�Ļ����Һ�У����ijһʱ�̻����Һ�У�c��CH3COO-�� / c��CH3COOH�� = 18�����ʱ��Һ��pH = ������֪��CH3COOH�ĵ��볣��Ka=1��8��10-5��
��4��Ϊ�ⶨʳ�ô��д��Ậ������ÿ��ʳ�������������������ʾ����λ��g/L�����������ʵ�飺a��ȡ20mlʳ������ƿ�У��μ�2��3�η�̪��ָʾ����b�����ʽ�ζ����м���1mol��L-1��NaOH��Һ������Һ�棬�����³�ʼ�̶ȡ�c����ʼ�ζ�������¼�ζ��յ�ʱ��ʽ�ζ��ܵĿ̶ȣ��ظ�����2��3�Ρ�
�� �ﵽ�ζ��յ�ʱ��������_______________________��
�� �����ⶨ������NaOH��Һ�����Ϊ10mL�����ʳ���д���ĺ����� ��
�� ������Щ�����ᵼ�²ⶨ�Ľ��ƫ��________������ĸ�������
a��װ��NaOH��Һǰδ��ϴ�ζ���
b���ζ��������Ӷ���
c���ζ������ζ��ܼ�˲���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�����ķϽ���м����Ҫ�ɷ�Ϊ��������ͭ��ij��ѧ��ȤС����ѧϰ��Ԫ�ؼ��仯��������֪ʶ���������ͼ1ʵ�����̣��øù����Ľ���������ȡ�Ȼ������̷�����(FeSO4��7H2O)�͵�������(CuSO4��5H2O)��


��ش�
(1)�������ڱ���λ�� ���� �塣
(2)�������е�ʵ������������� ��
(3)д�������Ӧ������C�����ӷ���ʽ�� ��
(4)���в����ʱ����С�� ����ͼ2��ʾװ�ü��Լ���ȡCO2�����Ƶõ�����ͨ����ҺA��һ��ʱ��۲쵽�ձ��в����İ�ɫ���������٣�ԭ���� ��
(5)�ù���F�Ʊ�CuSO4��Һ���������ͼ3����;����
д��;�����з�Ӧ�Ļ�ѧ����ʽ�� ����;�����Ʊ�CuSO4��Һʱ������������������������ʵ���֮��Ϊ ��
(6)��;�����Ʊ�CuSO4��Һ��;���١�������ŵ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ĵ���ƽ�ⳣ�����±���

����ѡ��������
A��2CN����H2O��CO2�D��2HCN��CO32��
B��2HCOOH��CO32���D��2HCOO����H2O��CO2��
C���к͵��������pH��HCOOH��HCN����NaOH����ǰ��С�ں���
D�����������Ũ�ȵ�HCOONa��NaCN��Һ��������������ǰ�ߴ��ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1��ʵ������Ҫ450 mL 0.02 mol/L����KMnO4����Һ������������
�� ������ƽ �� ������ �� ҩ�� �� 200mL�ձ� �� ��Ͳ������Ҫ ������������������ƣ������KMnO4���� g��
��2�����в�����ʹ���Ƶ�KMnO4��ҺŨ��ƫ����� ����д��ţ�����������������ȷ����
A��û����ȴ�����¾�ת��Һ�嵽����ƿ����ɶ��� |
B��ʹ������ƿ������Һ������ʱ�����ӿ̶��� |
C��û��������ˮϴ���ձ�2-3�Σ�������Һ��������ƿ�� |
D������ƿ��������ˮϴ����û�к�ɾ�����������Һ |
E������ʱ���μ�����ˮ������Һ���Ը��ڿ̶��ߣ���������ˮʹ��Һ����͵���̶�������
��3����ƽ����ķ���ʽ�����йصĻ�ѧ�������������ĺ����ϣ���
��KMnO4+��H2C2O4+��H2SO4������MnSO4+��K2SO4+��H2O+��CO2��
��4������ѪҺ��Ca2+��Ũ��һ����mg/cm3Ϊ��λ��Ϊ�ⶨѪҺ��Ʒ��Ca2+��Ũ�ȣ���ȡѪ��20.00 mL���������IJ����[��NH4��2C2O4]��Һ������������ƣ�CaC2O4��������������ϴ�Ӻ�����ǿ��ɵò��ᣨH2C2O4��������������0.02 mol/L ����KMnO4��Һ�ζ���ʹ����ת����CO2�ݳ�����ʱ������13.00 mL���� KMnO4��Һ�������ѪҺ��Ʒ��Ca2+��Ũ��Ϊ_________mg/cm3��������С�������λ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����9�֣���ӦA(g)+B(g)![]() C(g) +D(g) �����е������仯��ͼ��ʾ���ش��������⡣
C(g) +D(g) �����е������仯��ͼ��ʾ���ش��������⡣

��1���÷�Ӧ��________��Ӧ(������������������)��
��2������Ӧ�ﵽƽ��ʱ�������¶ȣ�A��
ת���� (��������������С����������)��
ԭ���� ��
��3����Ӧ��ϵ�м�������Է�Ӧ���Ƿ���
Ӱ��? ��ԭ���� ��
��4���ڷ�Ӧ��ϵ�м����������Ӧ��������
E1��E2�ı仯�ǣ�E1_______��E2_______
(��������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�������½��еĻ�ѧ��Ӧ��2SO2+O22SO3���ı�����������������߷�Ӧ���еĻ���Ӱٷ������ǣ� ��
A. �����¶� B. ����ѹǿ C. ��С��Ӧ��Ũ�� D. ����Ӧ��Ũ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ��A��H��Ϊ��ѧ��ѧ�г��������ʣ�A��B��H�����壬����֮��������ת����ϵ������Ӧ�����ɵ�ˮ����ȥ��
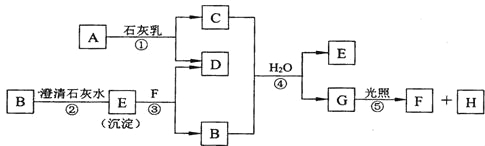
��ش��������⣺
��1������F�Ļ�ѧʽ�� ��
��2��C�������ճ������п��� ����
��3��д����Ӧ�ٵĻ�ѧ����ʽ�� ��
��4��д����Ӧ�۵����ӷ���ʽ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com