
 .
.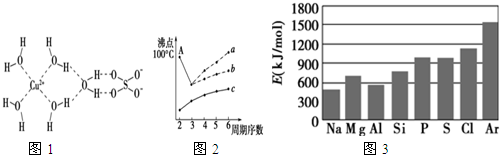
分析 (1)①铜是29号元素,其原子核外有29个电子,每个电子运动状态都不相同;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4;
(2)折线c中表示的氢化物沸点无反常现象,故属于IVA元素构成的氢化物(无氢键存在).A点沸点是100℃,可能是水,由于水分子间存在氢键,故水的沸点高于同主族元素形成的氢化物,固曲线b正确;
(1)①②由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,但原子处于半满、全满是,能量较低,第一电离能高于同周期相邻元素;
③同主族金属性越强,第一电离能越小.
解答 解:(1)①铜是29号元素,其原子核外有29个电子,每个电子运动状态都不相同,即有29个个运动状态不同的电子,故答案为:29;
②CuSO4•5H2O中铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4.水合铜离子的结构简式为 ,
,
故答案为: ;
;
(2)折线c中表示的氢化物沸点无反常现象,故属于IVA元素构成的氢化物(无氢键存在).A点沸点是100℃,可能是水,由于水分子间存在氢键,故水的沸点高于同主族元素形成的氢化物,固曲线b正确,
故答案为:IVA; b;由于水分子间存在氢键,水的沸点高于同主族元素形成的氢化物;
(1)①由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,故答案为:增大;
②由图可知,同周期内,随着原子序数的增大,E值变化的总趋势是增大,但原子处于半满、全满是,能量较低,第一电离能高于同周期相邻元素,故E氧<E氟,故答案为:<;
③同主族金属性越强,第一电离能越小则E镁>E钙,故答案为:>.
点评 本题是对物质结构的考查,涉及核外电子运动、配合物、氢键、电离能等知识,侧重考查学生分析、归纳总结能力,注意氢键对物质性质的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 石油裂解只破坏极性键 | |
| B. | 含极性键的共价化合物一定是电解质 | |
| C. | 氯化钠固体中的离子键在溶于水时被破坏 | |
| D. | HF的分子间作用力大于HCl,故HF比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
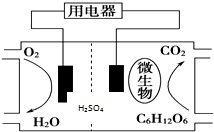
| A. | 葡萄糖在正极失去电子被氧化成CO2 | |
| B. | 微生物的作用是促进电路中电子的转移 | |
| C. | 质子通过交换膜从正极移向负极区 | |
| D. | 正极的电极反应式为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
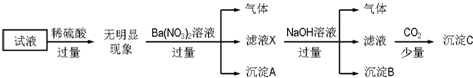
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com