
【题目】某温度下,BaSO4饱和溶液中加少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示该温度下BaSO4的溶度积常数,则平衡后的溶液中
A. c(Ba2+)=c(SO42-)=![]() B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
B. c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C. c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-) D. c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
科目:高中化学 来源: 题型:
【题目】下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理,下列说法不正确的是

A. 反应②为反应③提供了原料
B. 反应②也是SO2资源利用的方法之一
C. 制得等量H2所需能量较少的是系统(I)
D. 系统(I)制氢的热化学方程式为H2O(l) ![]() H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
H2(g) + 1/2O2(g) ΔH = +286 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是钢铁电化学保护的示意图。分析正确的是

A. 若a、b两端用导线相连,Fe作正极
B. 若a、b两端用导线相连,Zn被还原
C. 若a、b两端与电源相连,Fe作阳极
D. 若a、b两端与电源相连,Zn极得电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】E是一种能发生加聚反应的有机合成中间体,合成E的路线如下。

(1)反应①的类型是________________;反应②的试剂和条件是__________________。
(2)写出反应③的化学方程式_______________________________。
(3)D的结构简式___________。
D有多种同分异构体,写出一种符合下列要求的结构简式____________。
i. 含有苯环 ii. 能发生水解反应 iii. 苯环上的一溴代物有两种
(4)通过反应⑤得到E的产率不高,原因是___________________________。
(5)设计一条由CH3CH=CHCH3为原料制备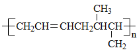 的合成路线。___________
的合成路线。___________
(合成路线常用的表示方法为:X![]() Y……
Y……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向 20mL0.2mol·L1H2A 溶液中滴加 0.2mol·L1NaOH 溶液,滴加过程中有关微粒的物质的量变化绘制在下图中。下列说法正确的是

A. 当 V(NaOH)=10mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H2A)>c(HA)>c(H+)>c(OH)
B. 当 V(NaOH)=20 mL 时,溶液中粒子浓度大小关系为:c(Na+)>c(H+)>c(HA)>c(A2)>c(H2A)
C. 当 V(NaOH)=30 mL 时,溶液中存在以下关系:c(A2)+2c(OH)=c(HA)+c(H+)+3c(H2A)
D. 当 V(NaOH)=40mL 时,溶液中存在以下关系:c(Na+)=2[c(A2)+c(HA)+ c(H2A)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列燃烧反应的反应热是燃烧热的是( )
A. H2(g)+![]() O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
O2(g)===H2O(g)ΔH1 B. C(s)+O2(g)===CO(g)ΔH2
C. S(s)+O2(g)===SO2(g)ΔH3 D. H2S(g)+![]() O2(g)===S(s)+H2O(l)ΔH4
O2(g)===S(s)+H2O(l)ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】说明氨水是弱碱的事实是: ( )
A. 氨水具有挥发性。 B. 1mol/L氨水溶液1升可以与1molHCl完全反应
C. 1mol/L NH4Cl溶液的pH=5 D. 氨水与AlCl3溶液反应生成Al(OH)3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是极其重要的化学元素。我国科学家最近成功合成了超高含能材料聚合氮和金属氮。基于氮气的能源研究也是未来能源发展的重要方向。
(1)基态氮原子的价电子排布式为___________。
(2)14g氮气分子中原子轨道以“头碰头”方式形成的共价键数目为___________,以“肩并肩”方式形成的共价键数目为___________。
(3)C、N、O三种元素按第一电离能从大到小的排列顺序为___________。已知氧的第一电离能为1369kJ·mol-1、第二电离能为3512kJ·mol-1、第三电离能为5495 kJ·mol-1,其第二电离能增幅较大的原因是___________。
(4)某含氨配合物CrCl3·6NH3的化学键类型有配位键、极性共价键和___________。CrCl3·6NH3有三种异构体,分别是[Cr(NH)3)6]Cl3、___________、[Cr(NH)4Cl2] Cl·2NH3。
(5)NH4N3是在的高能量度材料,其品胞构如图所示。N3-是直线型结构,N3-中氮原子的杂化类型是___________。NH4+的 VSEPR模型名称为___________。

(6)已知NH4N3的晶胞参数为anm和0.5anm,阿伏加德罗常数的值为NA,则NH4N3的密度为___________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com