
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
【答案】A
【解析】H2N(CH2)2NH2在a电极上失电子发生氧化反应,生成氮气、二氧化碳和水,则a为负极,电极反应式为H2N(CH2)2NH2+4H2O-16e-═2CO2↑+N2↑+16H+,氧气在正极b上得电子发生还原反应,电极反应式为:O2+4e-+4H+=2H2O,电子由负极经导线流向正极,阳离子向正极移动。A. 由上述分析可知,a是负极,b是正极,所以电子流动方向为a→导线→b,故A正确;B. a是负极、b是正极,H+经质子交换膜由左向右移动,故B错误;C. b的电极反应式为:O2+4e-+4H+=2H2O,所以b极附近溶液的pH增大,故C错误;D. H2N(CH2)2NH2在负极a上失电子发生氧化反应,生成氮气、二氧化碳和水,电极反应式为H2N(CH2)2NH2+4H2O-16e-═2CO2↑+N2↑+16H+,故D错误;答案选A。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H是原子序数依次增大的八种短周期元素。A原子的电子层数与它的核外电子数相同,A与E、D与G分别为同主族,D的最外层电子数是次外层的3倍,含B元素的化合物种类最多,C的某种氧化物为红棕色气体,F为地壳中含量最多的金属元素,B与E的核外电子数之和与H的核外电子数相同。请回答下列问题:
(1)H在周期表中的位置是__________________________。
(2)A、D、E三种元素形成的化合物的电子式为________,所含化学键类型有_________。
(3)A2D的沸点高于A2G,其原因是__________________________。
(4)G、H的最高价氧化物对应水化物的酸性强弱__________(填化学式)。
(5)上述元素可组成盐R:CA4F(GD4)2。向盛有10mL 1mol/L R溶液的烧杯中滴加1mol/L NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如下图所示:

①写出m点反应的离子方程式:_______________________。
②若在R中改加20mL 1.2mol/L Ba(OH)2溶液,充分反应,过滤,所得固体是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镁的氧化物熔点很高,是优质的耐高温材料
B.工业上采用热还原法来冶炼金属铁
C.二氧化硫因具有还原性,可以用来漂白纸浆
D.晶体硅是一种重要的半导体材料,是手机芯片中的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A.需要持续不断加热才能发生的反应一定是吸热反应
B.化学键的断裂和形成是化学反应中能量变化的根本原因
C.因为石墨变成金刚石吸热,所以石墨比金刚石稳定
D.燃料电池是一种高效且对环境友好的新型电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素X气态氢化物与其最高价氧化物的水化物反应生成盐,则该元素( )
A.在周期表中处于第三周期ⅦA族
B.在周期表中处于第2周期ⅥA族
C.氢化物比PH3稳定
D.常见化合价只有-3、+2、+3、+5价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。
(1)羰基硫的结构与二氧化碳相似,电子式为______________,硫原子的结构示意图______________
(2)羰基硫的氢解和水解反应是两种常用的脱硫方法:
氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH1=+7kJ/mol
H2S(g)+CO(g) ΔH1=+7kJ/mol
水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) ΔH2=-34kJ/mol
H2S(g)+CO2(g) ΔH2=-34kJ/mol
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ/mol
表示CO燃烧热的热化学方程式为________。
(3)氢解反应平衡后保持温度和压强不变通入适量的He,则正反应速率___________,COS的转化率_______(填“增大”、“减小”或“不变”)。
(4)若在绝热、恒容的密闭体系中,投入一定量COS(g)和H2(g),发生氢解反应,下列示意图能说明t1时刻反应达到平衡状态的是______(填字母序号)。(下图中υ正、K、n、m分别表示正反应速率、平衡常数、物质的量和质量)
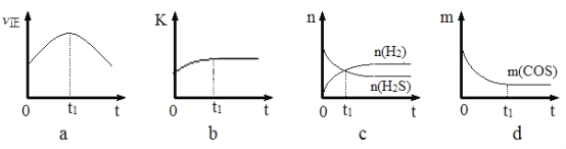
(5)某温度下,在体积为2 L密闭的容器中通入2molCOS(g)和4molH2O(g)发生上述水解反应,5 min后达到平衡,测得COS(g)的转化率是75%,回答下列问题:
①v(H2S)=________mol/(L·min)
②该温度下平衡常数K=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1HCl溶液滴定10.0mL浓度为0.1molL-1Na2CO3溶液,所得滴定曲线如图所示。下列微粒浓度大小关系正确的是

A. 当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)
B. 当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-)
C. 当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 当V=a时:c(Na+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com