
【题目】A、B、C、D、E、F、G、H是原子序数依次增大的八种短周期元素。A原子的电子层数与它的核外电子数相同,A与E、D与G分别为同主族,D的最外层电子数是次外层的3倍,含B元素的化合物种类最多,C的某种氧化物为红棕色气体,F为地壳中含量最多的金属元素,B与E的核外电子数之和与H的核外电子数相同。请回答下列问题:
(1)H在周期表中的位置是__________________________。
(2)A、D、E三种元素形成的化合物的电子式为________,所含化学键类型有_________。
(3)A2D的沸点高于A2G,其原因是__________________________。
(4)G、H的最高价氧化物对应水化物的酸性强弱__________(填化学式)。
(5)上述元素可组成盐R:CA4F(GD4)2。向盛有10mL 1mol/L R溶液的烧杯中滴加1mol/L NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如下图所示:

①写出m点反应的离子方程式:_______________________。
②若在R中改加20mL 1.2mol/L Ba(OH)2溶液,充分反应,过滤,所得固体是_____。(填化学式)
【答案】 第三周期,第ⅦA族 ![]() 离子键、共价键 分子间存在氢键 HClO4>H2SO4
离子键、共价键 分子间存在氢键 HClO4>H2SO4 ![]() BaSO4、Al(OH)3
BaSO4、Al(OH)3
【解析】A、B、C、D、E、F、G、H是原子序数依次增大的八种短周期元素。A原子的电子层数与它的核外电子数相同,A与E、D与G分别为同主族,A的原子序数最小,则A是H,E是Na。D的最外层电子数是次外层的3倍,则D是O,所以G是S。含B元素的化合物种类最多,B是C。C的某种氧化物为红棕色气体,C是N。F为地壳中含量最多的金属元素,F是Al。B与E的核外电子数之和与H的核外电子数相同,因此H是Cl。
(1)氯元素在周期表中的位置是第三周期,第ⅦA族。(2)A、D、E三种元素形成的化合物是氢氧化钠,电子式为![]() ,所含化学键类型有离子键和共价键。(3)由于水分子间存在氢键,所以H2O的沸点高于H2S;(4)氯元素的非金属性强于硫元素,所以G、H的最高价氧化物对应水化物的酸性强弱顺序HClO4>H2SO4。(5)①R是NH4Al(SO4)2,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3H2O,离子方程式为:NH4++OH-=NH3H2O;②10mL 1mol/LNH4Al(SO4)2溶液中Al3+物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2mol/L Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,由SO42-+Ba2+=BaSO4↓可知SO42-不足,故可以得到0.02mol BaSO4,根据方程式可知
,所含化学键类型有离子键和共价键。(3)由于水分子间存在氢键,所以H2O的沸点高于H2S;(4)氯元素的非金属性强于硫元素,所以G、H的最高价氧化物对应水化物的酸性强弱顺序HClO4>H2SO4。(5)①R是NH4Al(SO4)2,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3H2O,离子方程式为:NH4++OH-=NH3H2O;②10mL 1mol/LNH4Al(SO4)2溶液中Al3+物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2mol/L Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,由SO42-+Ba2+=BaSO4↓可知SO42-不足,故可以得到0.02mol BaSO4,根据方程式可知
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol
NH4++OH-=NH3H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故最终得到的固体是BaSO4、Al(OH)3。


科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,标出了A~K共十种元素所在位置。请用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是______,最活泼的金属是_____。
(2)C、E、F三种元素形成的简单离子半径最小的是_______。
(3)化合物C2B2的电子式为__________________;该化合物和AB2反应的化学方程式为__________________________________________。
(5)D的单质在A、B形成化合物中燃烧的化学方程式为________________________。
(6)用电子式表示H与B组成的H2B型化合物的形成过程_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,某科研小组采用如下方案由铬铁矿(主要成分为FeO·Cr2O3,还含有SiO2、Al2O3 等杂质)制备重铬酸钾。
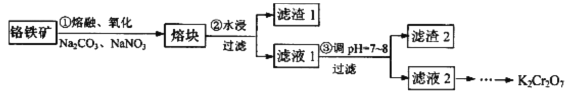
己知:①铬铁矿在熔融、氧化过程中发生的主要反应:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有关物质的溶解度如图所示。

(1)步骤①中反应物NaNO3的作用是_______,熔融时所用的仪器为________(填字母)。
A瓷坩埚 B.铁坩埚 C.氧化铝坩埚
(2)步骤②所得的滤渣1中含量最多的金属元素是___________。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用__________(填仪器或用品名称)测定溶液的pH,写出步骤③加醋酸生成Al(OH)3 的离子方程式____________________________________。
(4)请设计从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体的实验方案:__________(实验中须使用的试剂有: KC1固体、1mol/L硫酸溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体A在一定条件下可完全分解,生成B、C、D三种气体的混合物。反应方程式如下:2A=B↑+2C↑+3D↑,此时测得混合气体的相对平均分子质量为26,则固体A的摩尔质量为( )
A. 30g/mol B. 90g/mol C. 78g/mol D. 90
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是( )
A.浓硝酸保存在无色玻璃试剂瓶中
B.氢氧化钠溶液保存在具橡皮塞的玻璃试剂瓶中
C.少量的钠保存在煤油中
D.新制的氯水通常保存在棕色玻璃试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中含有的少量杂质(括号中的物质)的方法,错误的是( )
A.NH4Cl溶液(I2)用CCl4萃取
B.NO(NH3)通过水洗涤
C.NaCl(NH4Cl)加热固体混合物
D.N2(NO2)通过水洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中除含有Ca2+、Mg2+、SO![]() 等可溶性杂质外,还含有泥砂等不溶性杂质。
等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO![]() 的方法是_________________________________________________。
的方法是_________________________________________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。其中加入Na2CO3溶液的目的是___________________,滴加Na2CO3溶液时发生反应的化学方程式为________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组拟设计微生物燃料电池将污水中的乙二胺[H2N(CH2)2NH2]氧化成环境友好的物质,工作原理如图所示(a、b均为石墨电极)。下列分析正确的是)

A. 电子流动方向为a→导线→b
B. H+经质子交换膜由右向左移动
C. 放电一段时间b极附近pH不变
D. a电极发生反应:H2N(CH2)2NH2+16e-+4H2O==2CO2↑+N2↑+16H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com