
【题目】重铬酸钾是一种重要的化工原料,某科研小组采用如下方案由铬铁矿(主要成分为FeO·Cr2O3,还含有SiO2、Al2O3 等杂质)制备重铬酸钾。
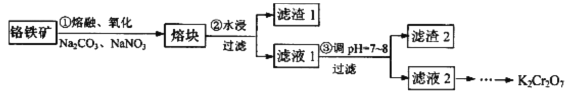
己知:①铬铁矿在熔融、氧化过程中发生的主要反应:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有关物质的溶解度如图所示。

(1)步骤①中反应物NaNO3的作用是_______,熔融时所用的仪器为________(填字母)。
A瓷坩埚 B.铁坩埚 C.氧化铝坩埚
(2)步骤②所得的滤渣1中含量最多的金属元素是___________。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用__________(填仪器或用品名称)测定溶液的pH,写出步骤③加醋酸生成Al(OH)3 的离子方程式____________________________________。
(4)请设计从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体的实验方案:__________(实验中须使用的试剂有: KC1固体、1mol/L硫酸溶液)。
【答案】 作氧化剂 B 铁 pH计(或pH试纸) CH3COOH+A1O2- +H2O =A1(OH)3 ↓+CH3COO- 向滤液2中加入足量的1mol/L硫酸溶液,充分反应后,再加适量KCl 固体,蒸发浓缩、冷却(至0℃~20℃均可),结晶,过滤,(冷水)洗涤,干燥
【解析】试题分析:由流程及题中信息可知,铬铁矿在熔融、氧化后,铬和铁的化合价分别升高到+6和+3;熔块经水浸后,铬酸钠、亚硝酸钠、偏铝酸钠、硅酸钠等可溶性盐被水浸出,过滤后,得到滤渣主要为氧化铁。将滤液调pH,偏铝酸钠、硅酸钠等转化为沉淀,过滤除去沉淀,滤液经酸化、分离提纯得到重铬酸钾。
(1)步骤①中反应物NaNO3的作用是作氧化剂,熔融时为防止坩埚被纯碱等物质腐蚀,所用的仪器为铁坩埚,选B。
(2)步骤②所得的滤渣1主要为氧化铁,所以其中含量最多的金属元素是铁。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用pH计(或pH试纸)测定溶液的pH。步骤③加醋酸生成Al(OH)3 的离子方程式为CH3COOH+A1O2- +H2O =A1(OH)3 ↓+CH3COO-。
(4)从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体,由信息②可知,先将滤液酸化,然后根据信息③中溶解度的数据,再向滤液中加入KCl,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得到产品。经优化后,具体的实验方案为:向滤液2中加入足量的1mol/L硫酸溶液,充分反应后,再加适量KCl 固体,蒸发浓缩、冷却(至0℃~20℃均可),结晶,过滤,(冷水)洗涤,干燥。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池的回收利用是发展循环经济的必经之路。其阴、阳极填充物(铅膏,主要含PbO、PbO2 等)是废旧铅蓄电池的主要部分,回收时所得黄丹(PbO)可用于合成三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其工艺流程如下:

(1)铅膏中加入Na2SO3溶液所发生的离子方程式_____________。
(2)操作I的名称__________。用18.4 mol L-1H2SO4 配制100 mL1 mol L-1H2SO4溶液需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、__________。
(3)滤液A能用来回收Na2SO4·10H2O,提取该晶体的主要步骤有蒸发浓缩、______、过滤、洗涤、干燥;检验该晶体中阴离子的实验方法是__________。
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重2.0% (![]() ×100%)的残留固体,若a点固体表示为PbOx或mPbO nPbO2,
×100%)的残留固体,若a点固体表示为PbOx或mPbO nPbO2,
列式计算x值_________和m:n值__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1mol H2SO4中含______mol氧原子,________个氢原子。
(2)4.5g水与________g硫酸所含的分子数相等,它们所含氧原子数之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要____________________。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
II.固定好滴定管并使滴定管尖嘴充满液体,调节液而至“0”或“0”刻度线以下,并记录读数
III.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
VI.用标准液滴定至终点,记录滴定管液血读数。
①上述滴定步骤中有错误的是(填编号)_________,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
②步骤IV中滴定时眼睛应________;判断滴定终点的现象是________。
③若步骤II中仰视读数,步骤IV中俯视读数,则会使测定结果____(填“偏大”、“偏小”或“无影响”)。
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=______;②烧碱样品的纯度为________%。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的前四周期的常见元素。己知:
A | 原子半径最小 |
B | 核外3个能级上的电子数相等 |
C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
D | 2p轨道上成对电子数与未成对电子数相等 |
E | N 层电子数为1,内层轨道全部排满电子 |
(1)写出E原子基态核外电子排布式_____________。比较B、C、D电负性的大小顺序______ (按由小到大) 。
(2)与C2互为等电子体的分子有_______,离子有_________。
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图),画出其中E2+离子与N、O原子间的化学键。________。

(4)E和金(Au)形成的合金的晶胞结构如图,则该合金的化学式可表示为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是NaOH与Na2CO3,NaOH与NaHCO3两种固体中分别逐滴加入稀盐酸反应的图像,其中说法错误的是

A. 若为NaOH与Na2CO3的混合物,0—a段的反应只有一个
B. 若为NaOH与NaHCO3的混合物,0—a段的反应只有一个
C. 两种固体中Na2CO3与NaHCO3的物质的量相同
D. 若为NaOH与Na2CO3的混合物,a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H是原子序数依次增大的八种短周期元素。A原子的电子层数与它的核外电子数相同,A与E、D与G分别为同主族,D的最外层电子数是次外层的3倍,含B元素的化合物种类最多,C的某种氧化物为红棕色气体,F为地壳中含量最多的金属元素,B与E的核外电子数之和与H的核外电子数相同。请回答下列问题:
(1)H在周期表中的位置是__________________________。
(2)A、D、E三种元素形成的化合物的电子式为________,所含化学键类型有_________。
(3)A2D的沸点高于A2G,其原因是__________________________。
(4)G、H的最高价氧化物对应水化物的酸性强弱__________(填化学式)。
(5)上述元素可组成盐R:CA4F(GD4)2。向盛有10mL 1mol/L R溶液的烧杯中滴加1mol/L NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如下图所示:

①写出m点反应的离子方程式:_______________________。
②若在R中改加20mL 1.2mol/L Ba(OH)2溶液,充分反应,过滤,所得固体是_____。(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.镁的氧化物熔点很高,是优质的耐高温材料
B.工业上采用热还原法来冶炼金属铁
C.二氧化硫因具有还原性,可以用来漂白纸浆
D.晶体硅是一种重要的半导体材料,是手机芯片中的主要成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com