
【题目】盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
【答案】CO(g)+FeO(s)=Fe(s)+CO2(g)△H=-218.0kJ/mol
【解析】
CO气体还原FeO固体生成Fe固体和CO2气体的化学方程式为:CO(g)+FeO(s)=Fe(s)+CO2(g);应用盖斯定律,消去Fe2O3(s)、Fe3O4(s),将[①![]() 3-②-③
3-②-③![]() 2]
2]![]() 6=1/2
6=1/2![]() ①-1/6
①-1/6![]() ②-1/3
②-1/3![]() ③得,CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=(-24.8kJ/mol
③得,CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=(-24.8kJ/mol![]() 3+47.2kJ/mol-640.5kJ/mol
3+47.2kJ/mol-640.5kJ/mol![]() 2)
2)![]() 6=-218.0kJ/mol,CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-218.0kJ/mol。
6=-218.0kJ/mol,CO气体还原FeO固体得到Fe固体和CO2气体的热化学方程式为CO(g)+FeO(s)=Fe(s)+CO2(g) ΔH=-218.0kJ/mol。


科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。

(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于加成反应的是
A.乙烯与氢气反应生成乙烷B.甲烷与氯气反应生成一氯甲烷
C.乙醇与氧气反应生成乙醛D.乙酸与乙醇反应生成乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为元素周期表的一部分,标出了A~K共十种元素所在位置。请用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | A | B | ||||||
3 | C | D | E | F | G | |||
4 | H | I | K |
(1)10种元素中,化学性质最不活泼的是______,最活泼的金属是_____。
(2)C、E、F三种元素形成的简单离子半径最小的是_______。
(3)化合物C2B2的电子式为__________________;该化合物和AB2反应的化学方程式为__________________________________________。
(5)D的单质在A、B形成化合物中燃烧的化学方程式为________________________。
(6)用电子式表示H与B组成的H2B型化合物的形成过程_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫的下列化学性质中,正确的是( )
A.SO2在一定条件下与O2反应转化为SO3
B.SO2使品红褪色是因为强氧化性
C.溶于水可直接形成硫酸
D.与碱反应能直接生成硫酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,某科研小组采用如下方案由铬铁矿(主要成分为FeO·Cr2O3,还含有SiO2、Al2O3 等杂质)制备重铬酸钾。
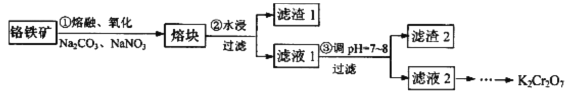
己知:①铬铁矿在熔融、氧化过程中发生的主要反应:
FeO·Cr2O3+Na2CO3+ NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CrO4+ Fe2O3+ CO2↑+NaNO2
Na2CO3+Al2O3![]() NaA1O2+CO2↑
NaA1O2+CO2↑
②2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
③有关物质的溶解度如图所示。

(1)步骤①中反应物NaNO3的作用是_______,熔融时所用的仪器为________(填字母)。
A瓷坩埚 B.铁坩埚 C.氧化铝坩埚
(2)步骤②所得的滤渣1中含量最多的金属元素是___________。
(3)步骤③可用醋酸调节滤液1的pH至7~8,可用__________(填仪器或用品名称)测定溶液的pH,写出步骤③加醋酸生成Al(OH)3 的离子方程式____________________________________。
(4)请设计从滤液2(主要溶质为Na2CrO4)制取K2Cr2O7固体的实验方案:__________(实验中须使用的试剂有: KC1固体、1mol/L硫酸溶液)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐中除含有Ca2+、Mg2+、SO![]() 等可溶性杂质外,还含有泥砂等不溶性杂质。
等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO![]() 的方法是_________________________________________________。
的方法是_________________________________________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。其中加入Na2CO3溶液的目的是___________________,滴加Na2CO3溶液时发生反应的化学方程式为________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com