
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是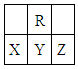
| A.原子半径大小:X >Y>Z |
| B.氢化物的稳定性:X >Y |
| C.化合物YR2能使品红溶液褪色 |
| D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D是原子序数依次增大的短周期主族元素,A、C在元素周期表中的相对位置如图,A元素最外层与次外层上的电子数之差为3,B为地壳中含最最多的金属元素。
| A | |
| | C |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Y、Z四种短周期主族元素的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是
| A.W、Y、Z的电负性大小顺序一定是Z>Y>W |
| B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.WY2分子中δ键与π键的数目之比是2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关物质性质的说法错误的是
| A.热稳定性:HCl> HI | B.原子半径:Na> Mg |
| C.结合质子能力:S2-> Cl- | D.酸性:H2SO3>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为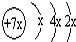 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为 ,下列比较中正确的是( )
,下列比较中正确的是( )
| A.原子半径:a>c>d>b | B.最高价氧化物对应水化物的酸性:c>d>a |
| C.原子序数:a>d>b>c | D.单质的氧化性:a>b>d>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com