
【题目】根据如图所示的转化关系以及现象回答下列问题。
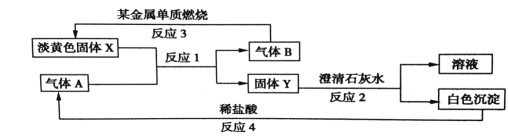
(1)固体 X的化学式是:________________
(2)写出反应1 的化学方程式:____________________________
(3)写出反应2 的离子方程式:________________________________
(4)若15.6gX 和足量的气体 A反应,转移__________mol 电子。
【答案】(1)过氧化钠 Na2CO3(2)2Na2O2+2CO2=2Na2CO3+O2(3)Na2CO3+Ca(OH)2= CaCO3↓+2NaOH(4)0.2
【解析】
试题(1)Na2CO3能与水及二氧化碳发生反应,所以与它反应的气体A是二氧化碳。(2)反应产生碳酸钠和氧气。固体Y是碳酸钠,气体B是氧气。钠在氧气中燃烧得到过氧化钠淡黄色固体。反应的方程式:2Na2O2+2CO2=2Na2CO3+O2。(3)二氧化碳与氢氧化钙发生反应产生碳酸钙沉淀和水。反应的方程式为:Na2CO3+Ca(OH)2= CaCO3↓+2NaOH。碳酸钙与盐酸发生反应生成氯化钙、水和二氧化碳。(4)Na2O2化学式的式量是78,15.6g过氧化钠的物质的量是0.2mol.根据化学方程式:2Na2O2+2H2O=4NaOH+O2↑可知若有2mol过氧化钠反应,转移电子2mol.现在有0.2mol发生反应,所以转移电子0.2mol.


科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系,其中①②③均为有单质参与的反应。
![]()
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式________。
(2)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是______,写出反应①的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍晶体(NiSO47H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:

已知: Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是_______________________________。
(2)操作a所用到的玻璃仪器有烧杯、________、________;操作c的名称为____________、____________、过滤、洗涤。
(3)固体①是______________;加H2O2的目的是(用离子方程式表示)_____________。
(4)调pH为2-3时所加的酸是________。
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?________(填“是”或“否”)。
(6)NiSO47H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器或装置,请回答下列问题:
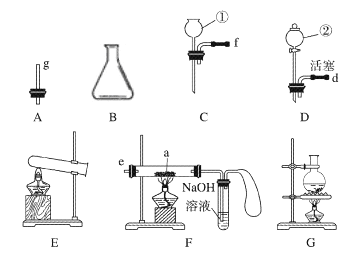
(1)仪器①的名称是_____,②的名称是_____。
(2)用上图仪器组装成气体发生装置:用KClO3和MnO2制O2应选的装置是______(填字母);用H2O2与MnO2制O2,并控制产生O2的速率,应选_____(填字母)。
(3)若用装置X进行“排空气法”收集制取的CO2,CO2应从_____(填“b”或“c”)端导入。若瓶中装满水,用排水法收集氧气,氧气应从_____(填“b”或“c”)端导入。
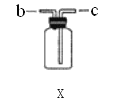
(4)若用F装置进行CO还原Fe2O3的实验,实验室制取CO的方法一般采用甲酸脱水法(HCOOH![]() CO
CO![]() +H2O),用纯净的CO完成该实验。
+H2O),用纯净的CO完成该实验。
①除F、X外还需要的装置有_____(填字母),X中应加入的试剂是_____,X与其他导管连接的顺序是_____(填导管口的序号);
②实验时 F装置中气球的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:

(1)溶液中一定含有的溶质是______________(填化学式)。
(2)溶液中一定不含有的溶质是____________(填化学式)。
(3)溶液中可能含有的溶质是__________(填名称),判断该物质是否存在的实验方法是________,现象是_____________。
(4)分别写出AB段、BC段发生的离子方程式:
①AB段为________________________________;
②BC段为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 碳酸氢钠溶液与盐酸反应: CO32-+2H+===CO2↑+H2O
B. 氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH-![]() H2O+NH3↑
H2O+NH3↑
C. 氢氧化镁与稀硫酸反应:H++OH-===H2O
D. 单质铜与稀硝酸反应:Cu+2H++2NO3-===Cu2++2NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验浓硫酸与木炭在加热条件下反应产生SO2和CO2气体,设计了下图实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用酸性高锰酸钾溶液浸湿的脱脂棉。

请回答下列问题:
(1)实验前需进行的操作是_______________________________
(2)写出圆底烧瓶中所发生的反应方程式____________________________________________
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,由此设计了虚框部分的装置,则正确的操作顺序是________(用编号填写);
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为______________
(5)当D中产生______(用字母填写)现象时,可以说明使E中澄清石灰水变浑的是CO2,而不是SO2;
A.进气口一端脱脂棉紫色变浅,出气口一端脱脂棉紫色不变
B.脱脂棉上紫色均变浅 C.脱脂棉上紫色褪去
则装置D的作用为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是基本有机化工原料,由乙炔制备聚乙烯醇和顺式聚异戊二烯的合成路线(部分反应条件略去)如图所示:
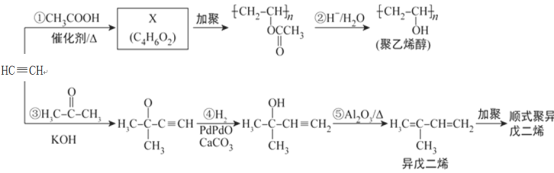
回答下列问题:
(1)按系统命名法命名异戊二烯:________________________________________。
(2)X分子中含有的官能团名称是________________________________________。
(3)反应①~③中,__________(填反应序号)的反应类型与反应④不同,反应⑤属于__________反应。
(4)与乙炔具有相同官能团的异戊二烯的同分异构体共有__________种。
(5)X的所有同分异构体在下列一种表征仪器中显示的信号(或数据)完全相同,该仪器是__________(选填字母)。
a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪
(6)顺式聚异戊二烯的结构式是(选填字母)__________。
a.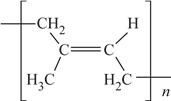 b.
b.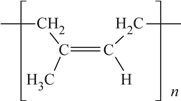
c.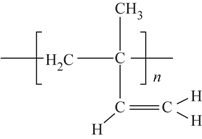 d.
d.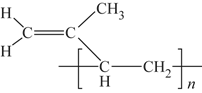
(7)参照异戊二烯的上述合成路线,设计一条由乙烯和乙醛为起始原料制备1,3-丁二烯的合成路线:_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com