
【题目】近年来,汽车尾气催化净化成为极其重要的环保产业。请回答下列问题:
I.治理汽车尾气中NO和CO的一种方法是在汽车的排气管道上安装一个催化转化装置。发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
(1)实际测试某汽车冷启动时的尾气催化处理CO、NO百分含量随时间变化曲线如图一,0~10 s阶段,CO、NO百分含量没有明显变化的原因是______;

(2)在密闭容器中充入10 mol CO和8 mol NO发生反应,测得平衡时NO的体积分数与温度、压强的关系如图二。

①已知T2>T1,则反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
N2(g)+2CO2(g),△H___0(填“>”、“=”或“<”)。
②为同时提高反应速率和NO的平衡转化率,可采取的措施有______(填字母序号)。
a.改用高效催化剂 b.缩小容器的体积
c.增加CO的浓度 d.升高温度
③压强为10MPa、温度为T1下,该温度下用分压表示的平衡常数Kp=___MPa-1(分压=总压×物质的量分数)。
II.汽车尾气中CO与N2O会发生反应:N2O(g)+CO(g)![]() CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
CO2(g)+N2(g) ΔH。几种物质的相对能量如下:
物质 | N2O(g) | CO(g) | CO2(g) | N2(g) |
相对能量/ kJ/mol | 475.5 | 283 | 0 | 393.5 |
(3)ΔH=___kJ/mol。
(4)实验室用Fe+作催化剂,以N2O和CO投入比为1:1模拟上述反应,其总反应分两步进行:
第一步:Fe++N2O![]() FeO++N2;
FeO++N2;
第二步:___(写反应方程式)。
催化过程中,c(N2)和c(CO2)几乎相等,由此判断该反应进行的快慢由第___步反应决定。
请在如图中绘制反应在催化剂作用下的“能量~反应过程”示意图___。已知:两步反应均放热。

【答案】尚未达到催化剂工作温度(或尚未达到反应的温度) < bc ![]() (或0.089) -365 FeO++CO
(或0.089) -365 FeO++CO![]() Fe++CO2 一
Fe++CO2 一 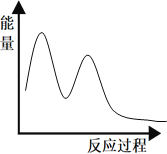
【解析】
(1)开始时温度较低、催化剂的活性不高;
(2)①根据压强相同时,温度与NO含量的关系分析判断反应的热效应;
②根据影响化学反应速率和化学平衡移动的条件分析;
③根据物质反应转化关系及平衡时NO的体积分数,计算平衡时各种气体的物质的量,结合在相同外界条件下,气体的物质的量的比等于体积比,用各自平衡分压代入平衡常数表达式,可得其平衡常数;
(3)根据△H=生成物所具有的总能量-反应物所具有的总能量;
(4)第二步反应中,中间产物(FeO+)氧化CO生成CO2本身被还原成Fe+;催化剂可降低反应的活化能、加快反应速率,且活化能大的反应速率慢,慢反应决定整个反应速率;
(1)任何催化剂都是在一定温度范围内达到其催化活性。反应开始时温度较低,尚未达到催化剂工作温度(或尚未达到反应的温度);
(2)①在压强不变时,T2>T1时,NO的体积含量增大,说明升高温度,活性平衡逆向移动,根据平衡移动原理“升高温度,活性平衡向吸热反应方向移动,逆反应为吸热反应,则该反应的正反应为放热反应,△H<0;
②反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0的正反应是气体体积减小的放热反应。
N2(g)+2CO2(g) △H<0的正反应是气体体积减小的放热反应。
a.改用高效催化剂,只能加快反应速率,不能使平衡发生移动,NO的平衡转化率不变,a不符合题意;
b.缩小容器的体积,物质的浓度增大,反应体系的压强增大,化学平衡正向移动,NO的平衡转化率增大,b符合题意;
c.增加CO的浓度,反应速率增大,化学平衡正向移动,NO的平衡转化率增大,c符合题意;
d.升高温度,化学反应速率增大,化学平衡向吸热的逆反应方向移动,NO的平衡转化率减小,d不符合题意;
故合理选项是bc;
③对于反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在反应开始时n(CO)=10 mol,n(NO)=8 mol,假设反应达到平衡时产生N2的物质的量为x mol,则同时产生CO2 2x mol,反应消耗NO、CO的物质的量为2x mol,所以平衡时n(CO)=(10-2x) mol,n(NO)=(8-2x) mol,n(N2)=x mol,n(CO2)=2x mol,由于在温度为T1,压强为10 Mpa时NO的含量为25%,所以
N2(g)+2CO2(g) △H<0,在反应开始时n(CO)=10 mol,n(NO)=8 mol,假设反应达到平衡时产生N2的物质的量为x mol,则同时产生CO2 2x mol,反应消耗NO、CO的物质的量为2x mol,所以平衡时n(CO)=(10-2x) mol,n(NO)=(8-2x) mol,n(N2)=x mol,n(CO2)=2x mol,由于在温度为T1,压强为10 Mpa时NO的含量为25%,所以![]() =25%,解得x=2 mol,故在该条件下的平衡分压Kp=
=25%,解得x=2 mol,故在该条件下的平衡分压Kp=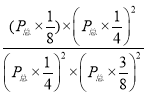 =
=![]() ,将P总=10 MPa代入,整理可得Kp=0.089 MPa;
,将P总=10 MPa代入,整理可得Kp=0.089 MPa;
(3)△H=生成物所具有的总能量-反应物所具有的总能量=(393.5+0-475.5-283)kJ/mol=-365 kJ/mol;
(4)第二步反应中,中间产物(FeO+)氧化CO生成CO2本身被还原成Fe+,反应为FeO++CO![]() Fe++CO2,两步反应均放热,物质相对能量越多,断键吸收能量越大,反应需要的活化能越大,反应越不容易进行,根据物质的相对能量可知第一步是慢反应,控制总反应速率,第二步反应速率大于第一步反应速率,所以在催化剂作用下的“能量~反应过程”示意图为
Fe++CO2,两步反应均放热,物质相对能量越多,断键吸收能量越大,反应需要的活化能越大,反应越不容易进行,根据物质的相对能量可知第一步是慢反应,控制总反应速率,第二步反应速率大于第一步反应速率,所以在催化剂作用下的“能量~反应过程”示意图为 。
。


科目:高中化学 来源: 题型:
【题目】氮和磷元素的单质和化合物在农药生产及工业制造业等领域用途非常广泛,请根据提示回答下列问题:
(1)科学家合成了一种阳离子为“N5n+”,其结构是对称的,5个N排成“V”形,每个N原子都达到8电子稳定结构,且含有2个氮氮三键;此后又合成了一种含有“N5n+”化学式为“N8”的离子晶体,其电子式为___,其中的阴离子的空间构型为___。
(2)2001年德国专家从硫酸铵中检出一种组成为N4H4(SO4)2的物质,经测定,该物质易溶于水,在水中以SO42-和N4H44+两种离子的形式存在。N4H44+根系易吸收,但它遇到碱时会生成类似白磷的N4分子,不能被植物吸收。1个N4H44+中含有___个σ键。
(3)氨(NH3)和膦(PH3)是两种三角锥形气态氢化物,其键角分别为107°和93.6°,试分析PH3的键角小于NH3的原因___。
(4)P4S3可用于制造火柴,其分子结构如图1所示。
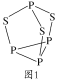
①P4S3分子中硫原子的杂化轨道类型为___。
②每个P4S3分子中含孤电子对的数目为___。
(5)某种磁性氮化铁的晶胞结构如图2所示,该化合物的化学式为___。若晶胞底边长为anm,高为cnm,则这种磁性氮化铁的晶体密度为__g·cm3(用含a、c和NA的式子表示)

(6)高温超导材料,是具有高临界转变温度(Te)能在液氮温度条件下工作的超导材料。高温超导材料镧钡铜氧化物中含有Cu3+。基态时Cu3+的电子排布式为[Ar]__;化合物中,稀土元素最常见的化合价是+3,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是___(填元素符号)。
几种稀土元素的电离能(单位:kJ·mol1)
元素 | I1 | I2 | I3 | I4 |
Sc(钪) | 633 | 1235 | 2389 | 7019 |
Y(铱) | 616 | 1181 | 1980 | 5963 |
La(镧) | 538 | 1067 | 1850 | 4819 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)![]() H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
H2(g)+CO2(g)。在500 ℃时,平衡常数K=9。若反应开始时,一氧化碳和水蒸气的浓度都是0.02 mol/L,则在此条件下CO的转化率为( )
A. 25% B. 50% C. 75% D. 80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料发生如图所示的变化,可以合成高聚物G。
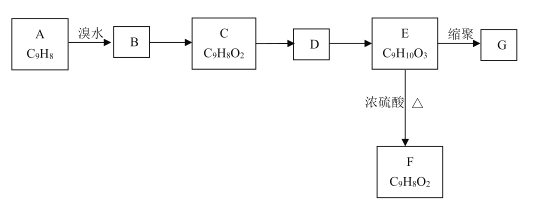
已知:①两个羟基连在同一碳原子上不稳定,会自动脱水。
②C能发生银镜反应,F能使溴水褪色。
回答下列问题:
(1)A中官能团的名称是________;C的结构简式为_________。
(2)B→C的反应条件是________,E→F的反应类型是_________。
(3)写出E→G的化学方程式________。
(4)E的同分异构体中,苯环上有4个取代基、遇FeCl3溶液显紫色且能与碳酸氢钠溶液反应的共有________种(不考虑立体异构)。其中核磁共振氢谱显示有4组峰的结构简式为________(写出一种即可)。
(5)参照上述合成路线,设计以丙炔为原料制备乳酸(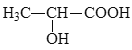 )的合成路线________(无机试剂任选)。
)的合成路线________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是

A. H2 B. CH3CH2OH(气) C. CO2 D. CO和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
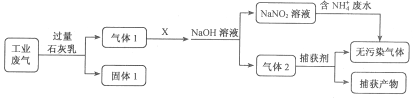
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com