
下列叙述正确的是 ( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:OH-(aq)+H+(aq)=H2O(l) H = -a kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量可能比阴极析出铜的质量小
D.对于2HI(g)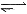 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
C
【解析】
试题分析:氨气分离出来,产物浓度减小,正逆反应速率减小。中和热是生成1mol水所放出的热量,1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应生成2mol水,所以热化学方程式为:OH-(aq)+H+(aq)=H2O(l)
H = -a/2 kJ·mol-1。精炼铜时,阳极是粗铜,放电的金属可能是比铜活泼的杂质也可能是铜,所以阳极溶解的金属质量有可能大于、等于或小于阴极析出的金属。对于2HI(g)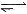 H2(g)+I2(g)平衡体系,增大压强,平衡不移动,但是物质的浓度变大,所以不能用勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大压强,平衡不移动,但是物质的浓度变大,所以不能用勒夏特列原理解释。
考点:化学反应原理
点评:本题综合性强,但是知识点比较基础,都是基本的概念问题。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com