
| A、若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol?L-1 |
| B、若V1=V2,反应后溶液的pH一定等于7 |
| C、若反应后溶液呈酸性,则V1一定大于V2 |
| D、若反应后溶液呈碱性,则V1一定小于V2. |


科目:高中化学 来源: 题型:
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,46 g 红棕色二氧化氮气体中含有N、O原子个数和为3NA |
| B、标准状况下,1 NA CH3Cl所占的体积约为22.4 L |
| C、N2(g)+3H2(g)?2NH3(g)△H=-a kJ/mol,现向一密闭容器中通入2 NA个氨气分子反应完全后,吸收a kJ热量 |
| D、足量铜与1 L 18mol?L-1浓硫酸反应可以得到SO2的分子总数小于9 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
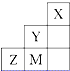
| A、电负性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
D、Z元素基态原子最外层电子排布图为 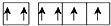 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| B、核外电子排布相同的微粒化学性质相同 |
| C、Cl-、S2-、Ca2+、K+半径逐渐减小 |
| D、还原性强弱:F-<Cl-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的沉淀BaSO4和pH的变化关系如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol?L-1Ba(OH)2溶液时,生成的沉淀BaSO4和pH的变化关系如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点对应溶液的pH:a=1 |
| B、生成沉淀的最大值m=2.33g |
| C、原混合液中盐酸的浓度为0.1 mol?L-1 |
| D、当V[Ba(OH)2]=10 mL时,发生反应的离子方程式为:Ba2++SO42-→BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.5g |
| B、5.0 g |
| C、10.0g |
| D、12.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.常温下ClO2是黄绿色,有刺激性气味的气体,液态呈红棕色,熔点为-59℃,沸点为11.0℃;
Ⅰ.常温下ClO2是黄绿色,有刺激性气味的气体,液态呈红棕色,熔点为-59℃,沸点为11.0℃;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用托盘天平称取35.20g NaCl |
| B、用10ml量筒量取8.50ml盐酸 |
| C、用25ml滴定管量取15.80ml溶液 |
| D、用广泛PH试纸测得溶液PH值为4.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com