
四种短周期元素A、B、C、D的原子序数依次递增.其中A、B、C三种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.161g/L,则在该化合物的分子中A原子的杂化方式为???? 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为?????? (填元素符号)。
(3)+1价气态基态阳离子再失去一个电子形成+2价气态基态阳离子所需要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电离能第一次突增应出现在第___电离能。
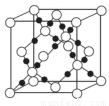
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于______________晶体.该晶体中A原子轨道的杂化类型为??????? 。
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间构型为???????????? 。
(6)C和D形成的一种离子化合物D2C的晶胞结构如图所示.该晶体中阳离子的配位数为?????? 。距一个阴离子周围最近的所有阳离子为顶点构成的几何体为????????? 。
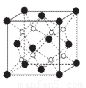
已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a=?? cm(用含ρ、NA的代数式表示)。
(1)sp (2)C<O<N (3)二(4)原子;sp3 (5)平面三角形? (6)4;正方体;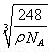
【解析】
试题分析:短周期元素A、B、C三种元素基态原子的2p能级上都有未成对电子.且未成对电子个数分别是2、3、2;则A的电子排布式为1s22s22p2,A为C元素;B的电子排布式为1s22s22p3.B为N元素;C的电子排布式为1s22s22p4.C为O元素。原子序数比O大的短周期元素D与O可以形成D2C和D2C2两种化合物,则D为Na。这两种氧化物分别为Na2O和Na2O2。(1)该C、H两元素形成的化合物的相对分子质量为:M=22.4L/mol×1.161g/L=26,所以该烃为乙炔,分子式为C2H2. 在该化合物的分子中C原子形成了2个δ键,2个Π键。即C的杂化方式为sp杂化。(2)一般情况下,同一周期的元素,原子核外的电子数越多,电离能越大。但当原子核外的电子处于全充满、半充满或全空时,能量较低。是稳定的状态。因此A、B、C这三种元素的第一电离能由小到大的顺序为C<O<N。(3)Na的核外电子排布式为1s22s22p63s1.当原子失去最外电子层上的1个3s电子后,次外电子层的2p电子处于全充满的稳定状态,失去较难。所以Na元素的电离能第一次突增应出现在第2电离能. (4)由CO2高温下形成的晶体的示意图可以看出:每个C与4个O形成共价键,每个O与2个C形成共价键。C原子处于与它相连的4个O原子构成的正四面体中心。这种正四面体结构向空间扩展就形成了一种立体网状结构。因此CO2高温下形成的晶体为原子晶体。在该晶体中C原子与4个O原子形成了4个δ键,因此其轨道的杂化类型为sp3。(5)C和O形成原子个数比为1:3的常见离子CO32-离子中的C是SP2杂化,结构式是平面三角形。(6)由离子化合物Na2O的晶胞结构可知:在一个晶胞中含有Na:8×1/8+6×1/2=4;含有O:1×8=8. 在该晶体中与Na+离子距离最近且相等的O2-有4个。所以它的的配位数为4. 距一个O2-离子周围最近的所有Na+离子为顶点构成的几何体为正方体。由于每个晶胞中含有4个Na2O. 晶胞的密度为ρ=m÷V=(4NA×M) ÷(NA×a3). a3=(4M) ÷(NA×ρ).所以a=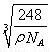 .
.
考点:考查原子结构、晶体结构、电离能、晶胞及空间构型等知识。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解



查看答案和解析>>
科目:高中化学 来源: 题型:

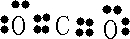
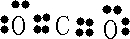
 H++Cl-+HClO
H++Cl-+HClO H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:

请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ② ③ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素A、B、C、D的性质或结构信息如下:
信息① 原子半径大小:A>B>C>D
信息② 四种元素之间形成的某三种分子的比例模型及部分性质:
请根据上述信息回答下列问题。
(1)B元素在周期表中的位置 ,请写出BC2分子的电子式 。
(2)A所在周期中,E元素的单质还原性最强,F元素的某些盐类常用作净水剂。E单质与甲反应有化合物X生成。请写出以下两个反应的离子方程式。
①A元素的单质与物质甲发生的反应 。
②F、C两种元素组成的化合物Y可作为高温结构陶瓷材料,X与Y两种化合物在溶液中发生的反应 。
(3)物质丁的元素组成和甲相同,丁分子具有18电子结构。向盛有一定浓度丁溶液的试管中,逐滴加入用少量稀硫酸酸化的硫酸亚铁溶液。滴加过程中的现象是:
①浅绿色溶液变成深棕黄色,②有少量气泡出现(经验证是氧气),片刻后反应变得剧烈,并放出较多热量,继续滴加溶液,静置一段时间,③试管中出现红褐色。向其中再滴入稀硫酸,红褐色变为黄色。请用化学方程式或离子方程式①、②、③中加点的字。
① ② ③ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com