
(1)用“单线桥”表示下列反应电子转移的方向和数目:2KMnO4 + 16HCl=" 2KCl" + 2MnCl2 + 5Cl2↑+ 8H2O 反应中物质的氧化性:KMnO4_____ Cl2(填“>、<、=”);氧化产物与还原产物的物质的量之比为_____________。
(2)配平下列氧化还原反应方程式:___KMnO4+___H2S+__H2SO4(稀) —— __K2SO4+__MnSO4+__S↓+__H2O
(3)Cl2是一种黄绿色有毒气体,化工厂可用浓氨水来检验有毒气体Cl2是否泄漏,有关反应的化学方程式为:3Cl2+8NH3=6NH4Cl +N2若反应中NH3消耗6.8 g,则转移电子个数为 。
科目:高中化学 来源: 题型:填空题
某化学反应的反应物和产物如下:Al+NaNO3+H2O Al(OH)3+N2+NaAlO2
Al(OH)3+N2+NaAlO2
(1)该反应的氧化剂是______________。
(2)该反应的氧化产物是_______________。
(3)反应过程中转移5 mol e-,生成标准状况下N2的体积________L。
(4)配平该反应的化学方程式:
______Al+_____NaNO3+_____H2O==______Al(OH)3+______N2+______NaAlO2。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)在3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O反应中,_______是氧化剂;_______是还原剂;_______元素被氧化;_______元素被还原;______是氧化产物;_______是还原产物,被还原的HNO3与参加反应的HNO3物质的量之比是___ __。用双线桥标出该反应电子转移的方向和数目。
(2)双线桥标出反应KClO3+ 6HCl=KCl + 3 Cl2↑ + 3H2O电子转移的方向和数目。(2分)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
水是人类生存和发展的宝贵资源,而水质的污染问题却越来越严重。目前,世界各国已高度重视这个问题,并采取积极措施进行治理。
(1)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下处理措施和方法都正确的是________(填字母编号,可多选)。
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含纯碱的废水 | 加石灰水反应 | 化学法 |
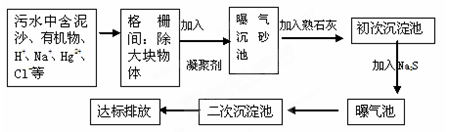
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以下反应①②可用于从不同原料中提取碘:
①2NaI+MnO2+3H2SO4 2NaHSO4+MnSO4+2H2O+I2
2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3 2Na2SO4+3NaHSO4+H2O+I2
2Na2SO4+3NaHSO4+H2O+I2
(1)反应①中的氧化剂是___________________;反应②中的还原产物是________________。
(2)根据反应①②可推知______。
a.氧化性:IO3->SO42- b.氧化性:MnO2>NaIO3
c.还原性:I->Mn2+ d.还原性:I2>NaHSO3
(3)已知NaI和NaIO3在酸性条件下能反应生成I2 ,写出该反应的离子方程式:
③__________________________________________________________。
(4)三个反应中生成等量的I2时转移的电子数最少的是反应________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下: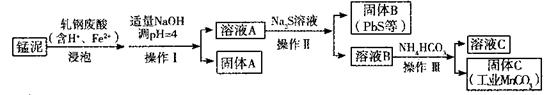
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中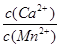 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O2、C1O2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:
2FeSO4 + 6Na2O2= 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑
①该反应中的氧化剂是 ,还原剂是 ,每生成l molNa2FeO4转移 mol电子。
②简要说明K2FeO4作为水处理剂时所起的作用 ,
。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、C1O-、OH-、FeO42-、C1-、H2O。
①写出并配平湿法制高铁酸钾的离子反应方程式: 。
②每生成1mol FeO42- 转移 mo1电子,若反应过程中转移了0.3mo1电子,则还原产物的物质的量为 mo1。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明什么问题 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
A、B、C、D、E为原子序数依次增大的5种短周期元素,A最外层电子数是其电子层数的两倍;B能形成双原子阴离子;C与B能形成两种常见的离子化合物,B、E同主族,C、D、E的最高价氧化物对应的水化物之间两两皆能反应生成盐和水。请回答下列问题:
(1)B的双原子阴离子电子式为 :用化学式表示一种由B、C、E组成的物质 。
(2)B的氢化物比E的氢化物的沸点 (填“高”或“低”),理由是 。
(3)B、C、D组成化合物的水溶液与过量AB2反应的离子方程式 。
(4)已知X是由上述五种元素中的两种组成的离子化合物,其离子具有相同的电子层结构,气体甲是天然气的主要成分。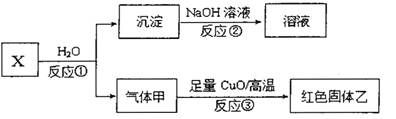
i.写出反应①的化学方程式 。
ii.若红色固体乙是一种单质,写出反应③的化学方稈式 。
(5)若某气体含有AB2和EB2中的一种或两种,请设计实验方案,探究该气体的成分 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com