
在 mol AL2(SO4)3中含0.3molSO42-,其中含Al3+ 个。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
(1)0.5molCH4的质量是 g,在标准状况下的体积为 L;含 有约 个氢原子。
将标准状况下22.4 L的HCl溶于水配成200 mL的溶液,所得溶液的物质的量浓度为 ;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
0.5mol H2SO4的质量是________g,含______________个分子,含________mol氧原子,能和________mol NaOH完全反应,该硫酸所含氢元素的质量与________g中所含氢元素的质量相同。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)按要求填空:
(1)以下物质:①NH3 ②CaCO3 ③酒精 ④饱和食盐水 ⑤Cu ⑥KOH ⑦HCl属于电解质的有 (填编号);
(2)14.7gH2SO4分子所含氢原子数与 L (标准状况下)NH3所含氢原子数相等;
(3)固体NaCl(I2)(括号内的物质为杂质),除去杂质的方法为 。
(4)要除去某食盐晶体中的CaCl2、MgCl2、Na2SO4等杂质,有以下操作:
| A.蒸发结晶 | B.过滤 | C.加入过量的Na2CO3溶液 | D.加水溶解 E、加入过量的烧碱溶液 F、加入过量稀盐酸 G、加入过量的Ba(NO3)2溶液 H、加入过量的稀硝酸 I、加入过量的BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
标准状况下,1体积水中能溶解500体积的HCl气体。若向1 L水中通入标准状况下的448LHCl气体,假设气体完全溶解。
(1)若所得溶液密度为1.2 g/cm3,则溶液中含HCl物质的量浓度为 ;
(2)从该溶液中取出10mL浓盐酸溶解于水配制成500mL溶液,配制后的稀溶液中含HCl物质的量浓度为 。
(3)在用浓盐酸配制上述稀盐酸时,所用仪器中,使用前必须检查是否漏液的仪器有 ;配制过程中,造成浓度偏低的操作可能有_______________(选填下列操作的序号)。
| A.容量瓶蒸馏水洗后未加干燥 |
| B.量筒用蒸馏水洗后未干燥 |
| C.将烧杯中浓盐酸移入容量瓶后,未用水洗涤烧杯,即向容量中加水到刻度 |
| D.用胶头滴管向容量瓶中加水时,不慎超过刻度线,用另外胶头滴管从瓶中吸出部分溶液使剩余溶液刚巧达刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。
请回答下列问题:
(1)反应①的离子方程式是______________
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②是放热反应,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,其中碳原子的杂化轨道类型是_______杂化。
(4)如果整个生产过程釆用绿色化学工艺,则生产120t尿素理论上需要 CH4___m3 (标准状况)。
(5)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电。尿素燃料电池结构如图所示,工作时负极的电极反应式为__________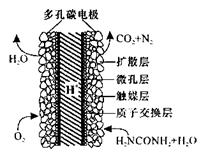
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
常温下,将20.0g质量分数为14.0%的KNO3溶液跟30.0g质量分数为24.0%的KNO3溶液混合,得到密度为1.15g·cm-3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在50mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100mL时测得c(NO3-)="3" mol·L-1。
(1)求稀释后的溶液的pH 。
(2)若生成的气体中NO2的物质的量为0.125 mol,则a=
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→NaNO2+NaNO3+H2O
若将上述的NO2和NO的混合气体通入2mol·L-1的NaOH恰好被吸收,求NaOH溶液的体积为 mL。生成的NaNO2为 mol。
(4)治理氮氧化物污染的另一种方法,可用氨氧混合气进行选择性催化还原处理。其主要反应原理如下:
4NO + 4NH3 + O2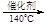 4N2 + 6H2O 6NO2 + 8NH3
4N2 + 6H2O 6NO2 + 8NH3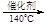 7N2 + 12H2O
7N2 + 12H2O
某硝酸厂排放的尾气中氮氧化合物的含量为2490mg/m3(体积已折算至标准状况),其中NO与NO2物质的量比为4∶1。设尾气中氮氧化物与氨氧混合气恰好完全反应。
①氨氧混合气的平均相对分子质量为 (精确到0.01)。
②要处理5m3的尾气,需要氨氧混合气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。请填空: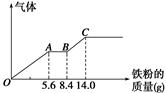
(1)AB段的反应的离子方程式为 ;
(2)原混合酸中NO3-物质的量浓度为 mol·L-1;
(3)原混合物中H2SO4物质的量为 mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com