
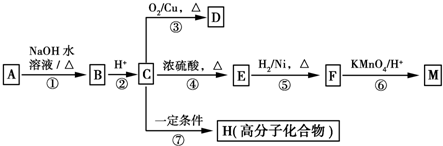
【题目】有机物A~M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色,D能发生银镜反应,M与足量的NaOH溶液反应后的产物,其一氯代物只有一种。
己知: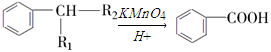 (R1、R2表示烃基或氢原子)
(R1、R2表示烃基或氢原子)
请回答:
(1)B的结构简式为_________。
(2)反应①~⑦中,属于氧化反应的是_______________(填反应序号)。
(3)写出反应④的化学方程式______________________。
(4)D与新制Cu (OH)2悬浊液反应的化学方程式为______________________。
(5)A的相对分子质量在180~260之间,从以上转化中不能确认A的某一官能团,下列确定该官能团的哪些实验方法是正确的______________。
A.取少量A于试管中,再加入苯振荡,观察分液后上层溶液颜色
B.取少量A于试管中,再加入NaOH溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3溶液,观察沉淀颜色
C.取少量A于试管中,再滴入AgN03溶液,再加入稀硝酸,观察沉淀颜色
D.取少量A于试管中,再加入NaOH的醇溶液共热,待冷却后加入稀硝酸调节至酸性,最后滴入AgNO3浴液,观察沉淀颜色
(6)符合下列条件的F的同分异构体共有____________种。
A.能发生银镜反应
B.能与FeC13溶液发生显色反应
C.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
【答案】(1)![]() ;
;
(2)③⑥;
(3) ;
;
(4) +2Cu(OH)2+2NaOH
+2Cu(OH)2+2NaOH![]()
 +Cu2O+4H2O;
+Cu2O+4H2O;
(5)bd;
(6)2;
【解析】
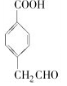
试题分析:A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,均含有-COOH,F的分子式为C9H10O2,不饱和度为![]() =5,且不能使溴的CCl4溶液褪色,不含不饱和键,应含有苯环,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其一氯代物只有一种,故F中应含有乙基,且与羧基处于对位,故F为
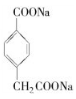
=5,且不能使溴的CCl4溶液褪色,不含不饱和键,应含有苯环,F发生氧化反应生成M,M与NaOH溶液反应后的产物,其一氯代物只有一种,故F中应含有乙基,且与羧基处于对位,故F为![]() ,M为
,M为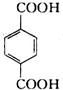 .由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为
.由A→B→C的转化可知,C中含有-COOH,C发生氧化反应生成D,D能发生银镜反应,结合F的结构可知,C为![]() ,故D为
,故D为![]() ,B为
,B为![]() ,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为
,A的相对分子质量在180260之间,故A中苯环上的乙基中不可能连接羟基,应为卤素原子,A的结构为![]() ,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为
,X相对原子质量大于180-28-76-45=31,小于260-28-76=111,X可能为Cl或Br.C发生消去反应生成E为![]() ,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为
,E与氢气发生加成反应生成F.C发生缩聚反应生成高聚物H为![]() 。
。
(1)B的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)反应①~⑦中,反应①属于取代反应,还发生中和反应,反应②属于复分解反应,反应③⑥属于氧化反应,反应④属于消去反应,反应⑤属于加成反应,反应⑦属于缩聚反应,故答案为:③⑥;
(3)反应④的化学方程式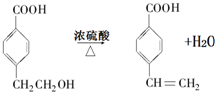 ,故答案为:
,故答案为: ;
;
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为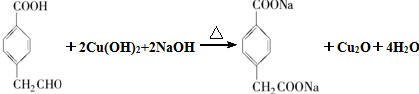 ,故答案为:
,故答案为: ;
;
(5)根据上面的分析可知,X可能为Cl或Br,要确定X是哪种官能团的实验步骤和现象为取反应①后的混合液少许,向其中加入稀HNO3至酸性,滴加AgNO3溶液,若生成白色沉淀,则A中含氯原子;若生成浅黄色沉淀,则A中含溴原子,故选bd;
(6)F(![]() )的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个-CHO,且2个甲基处于间位,另2个分别处于对位,所以F的同分异构体有2种,故答案为:2。
)的同分异构体:a.能发生银镜反应,说明分子中存在醛基;b.能与FeCl3溶液发生显色反应,说明分子中存在酚羟基;c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6,说明有4种氢原子,符合以上条件的F分子中有2个甲基、1个酚羟基、1个-CHO,且2个甲基处于间位,另2个分别处于对位,所以F的同分异构体有2种,故答案为:2。


科目:高中化学 来源: 题型:
【题目】“共建生态文明,共享绿色未来”。下列做法不符合这一主题的是( )
A.将绿色化学应用于化工生产中
B.综合利用化石燃料
C.以可降解餐具代替耐用型餐具
D.选择合适的“低碳”的出行方式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
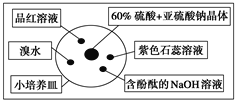
A. 紫色石蕊溶液变红色,说明SO2呈酸性
B. 品红溶液褪色,说明SO2具有漂白性
C. 溴水橙色褪去,体现了SO2的还原性
D. 含酚酞的NaOH溶液红色变浅,表明SO2能够和NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等试验(图中夹持装置有省略)。请按要求填空:
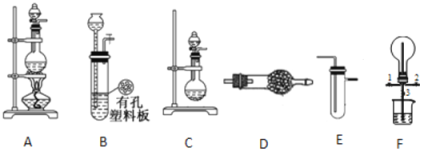
I.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与 (填装置编号)连接;装置C中的烧瓶内固体宜选用 。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是 。
(3)装置F可用于探究氯气与氨气(已知氯气与 氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入 ,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子 。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式 。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为 ;F的烧杯所起的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 碱性氧化物一定是金属氧化物
B. 质子数、中子数和电子数都相同的粒子一定是同一种粒子
C. 任何元素在自然界中的存在形式都有化合态和游离态
D. 酸性氧化物一定是非金属氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂,可区别Na2SO4、AlCl3、NH4Cl、MgSO4四种溶液,这种试剂是( )
A.HCl B.BaCl2 C.AgNO3 D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、请根据如下图所示转化关系回答有关问题。A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有强氧化性。
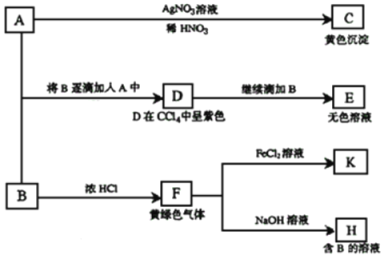
(1)写出A、B的化学式:A ,B 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: , 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
II、(1)将0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。在如下图所示坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图像。

(2)将18.4gNaOH和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6g。试计算混合物中NaOH的质量分数。(请写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com