
【题目】下列水溶液一定呈中性的是( )
A.c(NH4+)=c(Cl﹣)的NH4Cl和氨水的混合溶液
B.c(H+)=1.0×10﹣7molL﹣1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液
【答案】A
【解析】解:A.c(NH ![]() )=c(Cl﹣)的NH4Cl和氨水的混合溶液,根据电荷守恒c(NH
)=c(Cl﹣)的NH4Cl和氨水的混合溶液,根据电荷守恒c(NH ![]() )+c(H+)=c(OH﹣)+c(Cl﹣)得c(H+)=c(OH﹣),则该电解质溶液呈中性,故A正确; B.c(H+)=1.0×10﹣7molL﹣1的溶液中无法比较c(H+)、c(OH﹣)相对大小,所以无法判断溶液酸碱性,故B错误;
)+c(H+)=c(OH﹣)+c(Cl﹣)得c(H+)=c(OH﹣),则该电解质溶液呈中性,故A正确; B.c(H+)=1.0×10﹣7molL﹣1的溶液中无法比较c(H+)、c(OH﹣)相对大小,所以无法判断溶液酸碱性,故B错误;
C.95℃时纯水pH=6,则该温度下pH=7的溶液呈碱性,所以温度未知时不能根据pH判断溶液酸碱性,故C错误;
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液,要根据酸、碱的相对强弱判断溶液酸碱性,如果酸是弱酸、碱是强碱,则混合溶液呈酸性;如果酸是强酸、碱是强碱,则混合溶液呈中性,如果酸是强酸、碱是弱碱,则混合溶液呈碱性,故D错误;
故选A.


科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是
A.Na2SO4=2Na++SO42-B.FeCl3=Fe2++3C1-
C.Ba(OH)2=Ba2++(OH)22-D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁的单质及其化合物在储氢及大气治理等方面用途非常广泛。
I.工业上可以采用热还原法制备金属镁(沸点1107℃,熔点648.8℃)。 将碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]和焦炭按一定比例混合,放入真空管式炉中先 升温至700℃保持一段时间,然后升温至1450℃反应制得镁(同时生成可燃性气体)。
(1)用碳还原法制备金属镁需要在真空中而不在空气中进行,其原因是____________。
(2)碱式碳酸镁分解如图所示,写出在1450℃反应制得镁的化学方程式:_____________。

II.工业上利用纳米MgH2和LiBH4组成的体系储放氢(如题图所示)。

(3)写出放氢过程中发生反应的化学方程式:___________。
III.工业上MgO浆液是高活性的脱硫剂,常用来脱除烟气中的SO2。主要包含的反应有: ① Mg(OH)2+ SO2=MgSO3+H2O ② MgSO3+SO2+H2O= Mg(HSO3)2 ③ Mg(HSO3)2+ Mg(OH)2=2MgSO3+2H2O ④ 2MgSO3+O2=2MgSO4
脱硫时,MgO的脱硫效率、pH及时间的关系如题图所示。

己知20℃时,H2SO3的K1=l.54×10-2,K2=1.02×10-7,25℃时,Ksp[MgSO3]= 3.86×10-3,Ksp(CaSO3)= 3.1×10-7。
(4)脱硫过程中使浆液pH减小最显著的反应是______________(填①、②、③或④)。
(5)约9000s之后,脱硫效率开始急速降低,其原因是______________。
(6)其他条件相同时,镁基和钙基脱硫效率与液、气摩尔流量比如题图所示。镁基脱硫效率总比钙基大,除生成的MgSO4具有良好的水溶性外,还因为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中需要2.0mol/L的NaCl溶液950mL,配制该物质的量浓度溶液时,应选用容量瓶的规格和称取NaCl的质量分别是
A.950mL,111.2gB.500mL,117.0g
C.1000mL,117.0gD.1000mL,111.2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钌(Ru)是一种硬而脆呈浅灰色的多价稀有金属,性质很稳定,且耐腐蚀性很强。实验室用H2还原RuO2来制备金属钌的装置如图所示。下列说法不正确的是
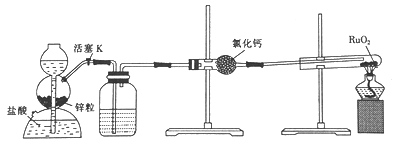
A. 加热试管前,应先收集气体并点燃,通过爆鸣声判断气体的纯度
B. 洗气瓶中盛装的可能是NaOH溶液,用于除去HCl
C. 结束反应时,先停止加热,再关闭活塞K
D. 启普发生器也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用软锰矿(主要成分为MnO2)来制取硫酸锰,工艺流程如下:
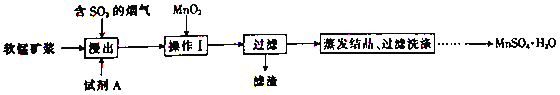
已知:浸出液中的金属离子主要是Mn2+,还含有少量的Fe2+。回答下列问题:
(1)实验室进行过滤操作时用到的玻璃仪器有玻璃棒、烧杯和______。
(2)浸出后,锰主要以Mn2+的形式存在,写出MnO2与SO2反应的离子方程式:____________。
(3)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将不利于软锰矿浆继续吸收SO2。欲消除生成的硫酸,可选用的试剂A是______(填字母)。
A.MnCO3 B.MnO2 C.Mn(OH)2 D.MnSO4
(4)操作I的目的是__________和调节溶液的pH至3~4。检验过滤后的滤液中是否含有Fe3+的操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数相同的是( )
A.10g H2和10g O2
B.5.6L N2(标准状况)和22g CO2
C.9g H2O和0.5mol Br2
D.224mL H2(标准状况)和0.1mol N2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com