
【题目】实验要快速制取H2 , 最好的方法是( )
A.纯锌和稀H2SO4反应
B.纯锌和浓硫酸反应
C.粗锌和浓H2SO4反应
D.粗锌和稀硫酸反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在25℃时,将amol?L﹣1的氨水与0.01 mol?L﹣1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl﹣),用含a的代数式表示NH3?H2O的电离常数:Kb= ![]()
B.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应生成Z,平衡后测得X、Y的转化率与起始时两物质的物质的量之比n(X)/n(Y>的关系如图所示,则x与Y的反应方程式可表示为:X+3Y?nZ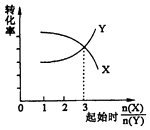
C.某同学在实验室进行了如图所示的实验,则Y中反应的离子方程式为:3CaCO3+2Fe3++3H2O═2Fe(OH)3+3CO2↑+3Ca2+
D.将10mL 1 mol?L﹣1Na2CO3溶液逐滴滴加到10mL1mol?L﹣1盐酸中,滴加结束后生成的溶液中有:C(Na+)>c(Cl﹣)>c(CO32﹣)>c(HCO3﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.纯净物一定由分子构成
B.混合物肯定由两种以上元素组成
C.同种分子构成的物质一定是纯净物
D.含有氧元素的化合物都是氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于2molSO2的叙述中,正确的是( )
A.体积为44.8 LB.含有4mol氧原子
C.分子数为6.02×1023D.摩尔质量为128 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下.
向硝酸酸化的0.05molL﹣1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色.
(1)检验产物
①取少量黑色固体,洗涤后,(填操作和现象),证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有 .
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示).针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测.同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3min时量小;溶液红色较3min时加深 |
ⅲ | 120 | 产生白色沉淀;较30min时量小;溶液红色较3 0min时变浅 |
(资料:Ag+与SCN﹣生成白色沉淀AgSCN)
②对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3﹣具有氧化性,可产生Fe3+;
假设d:根据现象,判断溶液中存在Ag+ , 可产生Fe3+ .
③下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因.实验Ⅱ可证实假设d成立.
实验Ⅰ:向硝酸酸化的溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3min时溶液呈浅红色,30min后溶液几乎无色.
实验Ⅱ:装置如图.其中甲溶液是 , 操作现象是 . 
(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com