
【题目】新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧 热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
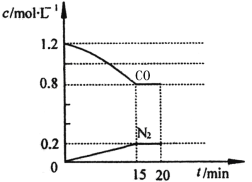
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
【答案】(1)![]()
(2)4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
(3)①40% 0.027mol/(L·min) ②c d ③向左 5/36 L/mol或0.14 L/mol
【解析】
试题分析:(1)CO2的电子式 ![]() 。
。
(2)2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1 ②
CO(g)+1/2O2(g)![]() CO2(g) △H=-c kJ·mol-1 ③
CO2(g) △H=-c kJ·mol-1 ③
根据盖斯定律由①-②+2×③得 4CO(g)+2NO2(g)![]() N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
N2(g)+4CO2(g) △H=-a+b-2c kJ·mol-1。
(3)① 2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol·L-1) 1.2 1 0 0
转化浓度(mol·L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol·L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为![]() ×100%=40%;0~15min NO的平均速率v(NO)=
×100%=40%;0~15min NO的平均速率v(NO)= ![]() =0.027mol/(L·min)。化学平衡常数K=
=0.027mol/(L·min)。化学平衡常数K=![]() =0.14。
=0.14。
②a.缩小容器体积,CO浓度增大,所以错误。
b.增加CO的量,CO浓度增大,所以错误。
c.降低温度,正向移动,CO浓度减小,所以正确。
d.扩大容器体积,CO浓度减小,所以正确。所以选c d。
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
瞬时浓度(mol·L-1) 0.8 0.6 0.4 0.6
Qc=![]() =0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是
=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是![]() L/mol或0.14 L/mol。
L/mol或0.14 L/mol。


科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别
B.汽油、乙烯均为石油分馏产品
C.可以用分液的方法分离硝基苯和苯
D.有机化合物都能燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在科研及生产中均有着重要的应用。
(1)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
气态PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)可逆反应PCl3(g)+Cl2(g)![]() PCl5(g) 2E(g)
PCl5(g) 2E(g)![]() F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
F(g)+G(g)分别在密闭容器的两个反应室中进行,反应室之间有可滑动、无摩擦的密封隔板。反应开始和达到平衡时有关物理量变化如图所示:
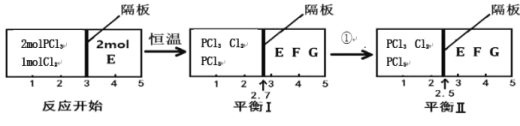
①达到平衡I时,体系压强与反应开始时体系压强之比为 。
②平衡I到平衡II的条件①是 (填“升温”或“降温”)。
(3)亚磷酸(H3PO3)与足量的NaOH溶液反应生成Na2HPO3。电解Na2HPO3溶液也可得到亚磷酸,装置如图所示:

阴极的电极反应式为________________;产品室中反应的离子方程式为 。
(4)一定温度下,Ksp [Mg3(PO4)2] =6.0×10-29,Ksp [Ca3(PO4)2] =6.0×10-26。向浓度均为0.20 mol·L-1的MgCl2和CaCl2混合溶液中逐滴加入Na3PO4,先生成 沉淀(填化学式);当测得溶液其中一种金属阳离子沉淀完全(浓度小于10-5mol/L)时,溶液中的另一种金属阳离子的物质的量浓度c= mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃与氢气加成后得到2,2-二甲基戊烷,烯烃的名称是
A. 2,2-二甲基-3-戊烯 B. 2,2-二甲基-4-戊烯
C. 4,4-二甲基-2-戊烯 D. 2,2-二甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C为短周期元素,在周期表中所处的位置如图所示。
A | C | |
B |
A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)写出A、B元素的名称 、 。
(2)B位于元素周期表中第 周期第 族。
(3)C的原子结构示意图为 。
(4)写出A的气态氢化物与其最高价氧化物对应的水化物反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g) ![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________热反应,且m+n______p (填“>”、“=”或“<”) 。
(2)减压时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B,则B的转化率__________。
(4)若升高温度,则平衡时B、C的浓度之比将__________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色__________;而维持容器内压强不变,充入氖气时,混合物颜色 。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图1:
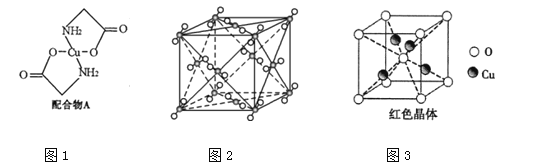
(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳,其结构如图2,它属于________晶体,每个CO2分子与________个CO2分子紧邻。写出二氧化碳的一种等电子体: (写化学式)。
(6) 已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图3,则该化合物的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是
A. 离子化合物不可能含共价键 B. 共价化合物可能含离子键
C. 离子化合物中只含离子键 D. 共价化合物中不含离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A.该反应的化学方程式为3B+2D 6A+4C
B.反应进行到1 s时,v(A)=3v(D)
C.反应进行到6 s时,B的平均反应速率为0.1mol/(Ls)
D.反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com