
【题目】合成药物异搏定路线中某一步骤如下:
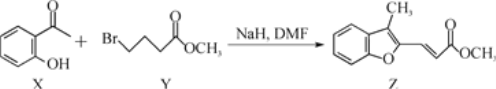
下列说法错误的是( )
A.物质X中所有原子可能在同一平面内
B.物质X在空气中易被氧化
C.等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1∶2
D.等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为4:6
【答案】AD
【解析】
A.X中苯环、羰基均为平面结构,但甲基中的碳是sp3杂化,为立体结构,则分子内所有原子不可能在同一平面内,故A错误;
B.X中含有酚羟基,性质不稳定,易被氧气氧化,故B正确;
C.X中只有酚羟基能和NaOH反应,而Y中酯基水解生成的羧基能和NaOH反应,溴原子水解生成的HBr能和NaOH反应,所以等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2,故C正确;
D.X分子结构中的苯环和羰基均能和H2发生加成反应,Z分子结构中的苯环和碳碳双键能和H2发生加成反应,但酯基不能和H2发生加成反应,则等物质的量的X、Z 分别与H2加成,最多消耗H2的物质的量之比为4:5,故D错误;
故答案为AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源、环保等方面有着广泛的用途。利用湿法、干法制备高铁酸盐的原理如表所示。
湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
干法 | Fe2O3、KNO3、KOH混合加热生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上利用湿法制备高铁酸钾(K2FeO4)的流程如图所示:
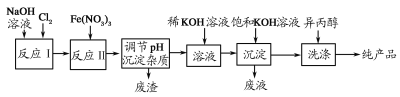
①反应Ⅰ的化学方程式为_____________。
②反应Ⅱ的离子方程式为_______________。
③加入饱和KOH溶液的目的_____________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为___________。
(3)干法制备K2FeO4的反应中,氧化剂是________。
(4)高铁电池是正在研制中的可充电干电池,如图为该电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有________、________。
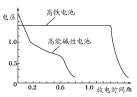
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生做浓硫酸性质的实验:
在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有NaOH溶液的棉花。加热试管,观察现象。
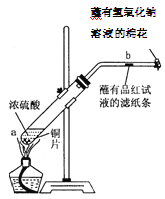
回答下列问题:
(1)写出试管中发生反应的化学方程式____________________。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为_______________,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为_____________。
(3)蘸有NaOH溶液的棉花团作用是________________________________________。
(4)硫酸型酸雨的形成过程可用下列反应中的__________来表示。
A:SO2+H2O![]() H2SO3
H2SO3
B:O2+2H2SO3=2H2SO4
C:SO2+H2O2=H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向葡萄酒中加入Na2S2O5抗氧化。测定某葡萄酒中Na2S2O5残留量的方法:取50.00ml葡萄酒样品,用0.0100molL-1的碘标准液滴定至终点,消耗标准液10.00ml。则该样品中Na2S2O5的残留量为![]() 已知
已知![]()
![]()
A.0.001gL-1B.0.002gL-1C.0.064gL-1D.0.19gL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 mL 0.1 mol/L氨水与10 mL 0.1 mol/L盐酸混合:c(Cl)>c(![]() )>c(OH)>c(H+)
)>c(OH)>c(H+)
B. 10 mL 0.1 mol/L NH4Cl溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl)>c(OH)>c(H+)
C. 10 mL 0.1 mol/L CH3COOH溶液与5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO)>c(OH)>c(H+)
D. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是 ( )
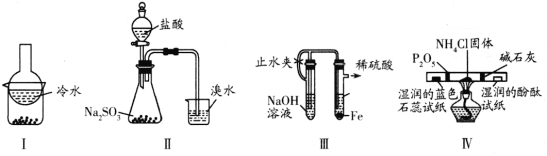
A. 加热装置I中的烧杯分离I2和高锰酸钾固体
B. 用装置II验证二氧化硫的漂白性
C. 用装置III制备氢氧化亚铁沉淀
D. 用装置IV检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
![]() 航天领域中常用
航天领域中常用![]() 作为火箭发射的助燃剂。
作为火箭发射的助燃剂。![]() 与氨气相似,是一种碱性气体,易溶于水,生成弱碱
与氨气相似,是一种碱性气体,易溶于水,生成弱碱![]() 用电离方程式表示
用电离方程式表示![]() 显碱性的原因是:________________。
显碱性的原因是:________________。
![]() 在恒温条件下,
在恒温条件下,![]() 和足量C发生反应
和足量C发生反应![]() ,测得平衡时
,测得平衡时![]() 和
和![]() 的物质的量浓度与平衡总压的关系如图所示:
的物质的量浓度与平衡总压的关系如图所示:
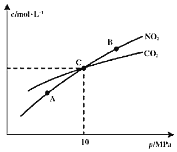
![]() 、B两点的浓度平衡常数关系:
、B两点的浓度平衡常数关系:![]() ______
______![]() 填“
填“![]() ”或“
”或“![]() ”或“
”或“![]() ”
”![]()
![]() 、B、C三点中
、B、C三点中![]() 的转化率最高的是______
的转化率最高的是______![]() 填“A”或“B”或“C”
填“A”或“B”或“C”![]() 点。
点。
![]() 计算C点时该反应的压强平衡常数
计算C点时该反应的压强平衡常数![]() ______
______![]() 是用平衡分压代替平衡浓度计算,分压
是用平衡分压代替平衡浓度计算,分压![]() 总压
总压![]() 物质的量分数
物质的量分数![]() 。
。
![]() 已知:亚硝酸
已知:亚硝酸![]() 性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数
性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数![]() ;
;![]() 的
的![]() ,
,![]() 在常温下向含有2mol碳酸钠的溶液中加入1mol的
在常温下向含有2mol碳酸钠的溶液中加入1mol的![]() 后,则溶液中
后,则溶液中![]() 、
、![]() 和
和![]() 的离子浓度由大到小的顺序是______。
的离子浓度由大到小的顺序是______。
![]() 已知:常温下甲胺
已知:常温下甲胺![]() 的电离常数为
的电离常数为![]() ,且
,且![]() 水溶液中有
水溶液中有![]() ,常温下向
,常温下向![]() 溶液滴加稀硫酸至
溶液滴加稀硫酸至![]() 时,则溶液
时,则溶液![]() ______。
______。
![]() 一种煤炭脱硫技术可以把硫元素以
一种煤炭脱硫技术可以把硫元素以![]() 的形成固定下来,但产生的CO又会与
的形成固定下来,但产生的CO又会与![]() 发生化学反应,相关的热化学方程式如下:
发生化学反应,相关的热化学方程式如下:![]()
![]()
![]() ,反应
,反应![]() ______
______![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(选修3:物质结构与性质)
工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
CH3CH2OH+H2O。研究发现,使用TiO2作为载体负载铑基催化剂具有较高的乙醇产量。回答下列问题:
(1)Ti基态原子核外电子排布式为_______。和O同一周期且元素的第一电离能比O大的有_____(填元素符号),和O同一周期且基态原子核外未成对电子数比O多的有____(填元素符号)。
(2)在用合成气制取乙醇反应所涉及的4种物质中,沸点从低到高的顺序为______________。
(3)工业上以CO、O2、NH3为原料,可合成氮肥尿素[CO(NH2)2],CO(NH2)2分子中含有的σ键与π键的数目之比为_________。
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。
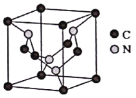
①该晶体的化学式为______;其硬度超过金刚石的原因是___________。
②已知该晶胞的密度为d g/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为__________________(用含d、r1、r2、NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com